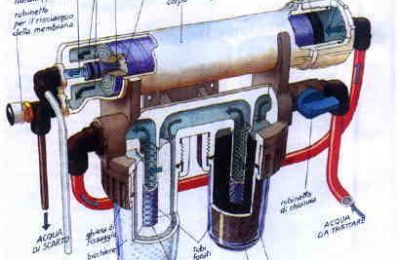
Come allevare con successo piante alofile come Rhizophora, Avicennia e Salicornia, e utilizzo del loro vantaggio aereo per filtrare nutrienti nell’acquario marino.
INTRODUZIONEOrmai da diversi anni nel mondo dell’acquariofilia hanno fatto la loro comparsa le mangrovie, e attorno a loro sono iniziate molte discussioni sul fatto che siano o meno degli ottimi filtratori per le sostanze nocive in vasca. Leggendo le esperienze degli appassionati si trovano pareri contrastanti, c’è chi testimonia l’azzeramento di nitrati e fosfati nel giro di poche ore, e chi invece non ha notato alcuna differenza. A cosa sono dovute queste discrepanze? La mangrovia in natura è un’albero alto molti metri su cui si basano interi ecosistemi in varie parti del mondo, come mai nei nostri acquari è lenta e stenta a crescere? La risposta è che spesso è stato dato ala mangrovia un’ambiente inadatto a svolgere il suo compito, e la causa è nella grande conoscenza che l’acquariofilo ha su pesci e coralli e la notevole ignoranza (intesa come non conoscenza) su come far crescere un’albero. Nei siti e forum dedicati all’argomento si trovano tante esperienze personali ma nessuna documentazione che spieghi “come” la pianta funzioni, “cosa” necessiti per vivere e quindi funzionare al meglio, e cosa molto importante “come” influisce sull’ecologia del piccolo ecosistema acquario. Io nella vita sono per prima cosa un botanico, ma sono anche un’acquariofilo, nel tentativo di fare chiarezza sull’uso di piante terrestri negli acquari marini ho unito la conoscenza dei miei studi a nuove ricerche fatte su questo argomento specifico, ho trovato interessanti trattati sull’ecologia acquatica in acqua dolce e marina (così diverse e così simili), questi testi raccontano che rispetto alle alghe (più semplici e primitive) le piante anfibie hanno un vantaggio evolutivo ottenuto in milioni di anni che gli consente di avere risultati migliori. Adoperando quelle poche piante terrestri che sono tornate al mare come la Rhizophora, l’Avicennia e la Salicornia, noi acquariofili abbiamo la possibilità di sfruttare questo vantaggio evolutivo a favore della nostra vasca. In questo scritto con piante superiori intendo le forme vegetali più evolute come le piante terrestri ma anche quelle sommerse in ambiente marino come la Posidonia e la Zostera, sono escluse le alghe. Per piante sommerse intendo tutto quello che cresce sott’acqua: sia piante superiori che alghe. Tra parentesi quadra […] sono segnati i riferimenti alla bibliografia.
IL CARBONIO COME FATTORE LIMITANTE NELLA CRESCITA DI PIANTE SOMMERSEL’anidride carbonica (CO2) è l’unica fonte di carbonio per tutti gli organismi autotrofi a partire dalle zooxantelle e cianobatteri fino alle piante più evolute sulla terra ferma. Sebbene la crescita delle piante sommerse possa apparire veloce, per esempio in un’alga del genere Caulerpa, la maggior parte di quella “crescita” può essere semplicemente costituita da acqua. Si è potuto appurare che le piante sommerse contengono solo il 6,7 % di materia secca mentre una foglia di pianta terrestre ne contiene mediamente il 20% ciò significa che una pianta terrestre potrebbe consumare 3 volte di più rispetto a qualsiasi cosa cresca sotto l’acqua. La scarsa produttività delle piante sommerse non è dovuta al fatto che nell’acqua è presente meno CO2 rispetto all’aria [1][2], ma è dovuta al fatto che la CO2 si diffonde nell’acqua molto lentamente (circa 10000 volte più lentamente che nell’aria). Questo semplice fenomeno fisico limita l’assorbimento di carbonio da parte dell’organismo e la sua velocità di crescita.
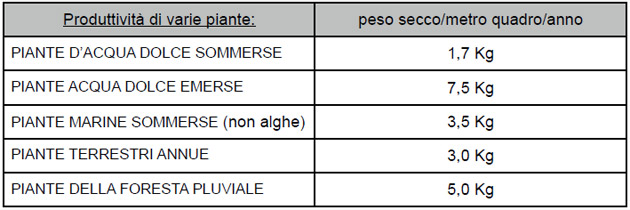
Tuttavia se il lento movimento della CO2 nell’acqua fosse l’unico problema per le piante sommerse, allora le piante marine come la Posidonia sarebbero improduttive al pari delle piante di acqua dolce, invece come vedete dal grafico cresco molto di più. Dalle ricerche, due piante superiori marine, la Zostera marina e la Thalassia testudinum, hanno dimostrato di essere dal 50 al 200 % più produttive dell’Hydrilla verticillata e del Myriophyllum spicatum, due specie di acqua dolce che crescono velocemente [3]. La differenza consiste nel fatto che le piante marine hanno la certezza di un vasto e continuo apporto di carbonio dovuto al carbonato presente nell’acqua di mare. Al contrario le piante sommerse in acqua dolce stagnante devono fare i conti con forti variazioni di CO2 … ma non ci interessa adesso. Negli acquari marini macroalghe come Neomeris ed Halimeda costruiscono i loro scheletri calcarei proprio con questo meccanismo chiamato decalcificazione biogena: dal carbonato di calcio in soluzione estraggono CO2 come fonte ci carbonio e calcio per lo scheletro. Come si vede nella tabellina, le piante che possono raggiungere l’aria hanno un’efficienza fotosintetica maggiore, e quindi una crescita e una filtrazione di inquinanti dall’acqua maggiore: questo viene chiamato “vantaggio aereo”. Le piante e l’assorbimento di ammoniaca, nitriti e nitrati.L’ammoniaca è uno dei più importanti e comuni agenti inquinanti degli acquari. I pesci e i batteri secernono ammoniaca come prodotto di scarto del loro metabolismo. L’ammoniaca (NH3) che è tossica, esiste in equilibrio con l’ammonio (NH4.). La percentuale di ammoniaca in una soluzione cambia nettamente con il pH, essa aumenta di 10 volte per ogni aumento di unità di pH. Ad esempio se il pH passa da 7 ad 8 la percentuale di azoto che costituisce NH3 passa dallo 0,33% al 3,3%, mentre la percentuale di azoto che appartiene al NH4 passa, proporzionalmente, da 99,7 % al 96,7% [4] Questo significa che la tossicità dell’ammoniaca è maggiore in acquari marini che in quelli dolci proprio per il pH più alto che questi presentano. L’ammoniaca può ridurre la crescita o uccidere le piante ma questo avviene a concentrazioni che avrebbero già sterminato ogni pesce e corallo, nelle nostre vaschesemmai si può avere una carenza di ammonio… almeno dal punto di vista delle piante. Le piante e le alghe possono nutrirsi di azoto “prevalentemente” in forma ammoniacale, e quindi sono nostre alleate nella rimozione di questo inquinante dall’acquario. Tutte le piante assorbono rapidamente l’ammoniaca [5], ne sono avidissime. Quando l’NH3 entra nella cellula può combinarsi con lo ione idrogeno (H.) e convertirsi in ammonio non tossico (NH4.) [6] che può essere immagazzinato dalla pianta nei vacuoli delle cellule in concentrazioni anche di 2400 mg/L. Oltre a questo impressionante dato sull’immagazzinamento, le piante eliminano ammoniaca dall’acqua utilizzandola immediatamente per la sintesi delle proteine.
La maggior parte delle piante acquatiche allo studio, quando sottoposte ad una scelta tra ammonio e nitrati come sorgente di azoto, assorbono esclusivamente ammonio, solo quando l’ammonio non è disponibile le piante assorbono i nitrati. Questa preferenza è dovuta al fatto che piante e alghe possono usare solo ammonio per la sintesi delle proteine, quando assorbono nitrati esse devono spendere energia (83 Kcal/mol) per trasformare di nuovo i nitrati in ammonio [7]. Questo si ricollega a quanto detto prima sul fatto che le piante emerse possono prendere la CO2 dall’aria ottenendo un grande vantaggio nella crescita, maggiore carbonio significa maggiore necessità di tutti gli altri elementi come azoto, fosforo, potassio… il discorso non fa una piega. Le piante emerse hanno ancora altri vantaggi sulle alghe che possono essere interessanti in vasca, e il fatto che alcune piante sono resistenti all’acqua marina, come le mangrovie e la salicornia, inizierete a considerarlo una benedizione. La cosa che influisce più di tutto sull’ecosistema “acquario” è che le radici di tutte le piante superiori rilasciano ossigeno nell’ambiente, il rilascio può essere limitato o considerevole, può dipendere dalla specie o dall’età della pianta; ed è sicuro che se tutte le piante acquatiche lo fanno, le piante emerse lo fanno al massimo dell’efficienza, una Zostera marina ossigena il fondo in maniera trascurabile rispetto a ciò che può fare una pianta emersa. L’ossigenazione delle radici giova in tre modi alle piante acquatiche: CRESCITA -prendendo l’ossigeno dall’aria (che ne contiene un’abbondante 21%) e portandolo alle radici per la loro ossigenazione, si garantisce una più veloce crescita della radice e quindi un maggiore potere filtrante.
ELIMINAZIONE DELLE TOSSINE DAL SUBSTRATO -Ad esempio il ferro solubile in eccesso risulta potenzialmente tossico per le radici delle piante. Il rilascio di ossigeno da parte delle radici fa precipitare il ferro come ossido sulla parte esterna delle radici e, in tal modo, impedisce al ferro in eccesso di entrare nelle radici [8]. La precipitazione del ferro è visibile sotto forma di macchie marroncine o precipitati sulle radici. Questo è un fattore alleato nella lotta contro le alghe proprio perché la limitata disponibilità di ferro in acque ossigenate relega il ferro in una posizione diversa da tutti gli altri nutrienti delle piante. Questo perché il ferro libero (Fe². e Fe³.), che è l’unica forma che le alghe possono utilizzare [9] non si accumula comunemente in acqua ma si lega al carbonio organico disciolto oppure forma vari precipitati. La pianta prende il ferro che le serve e il resto lo neutralizza, inibendoper carenza di ferro Caulerpa e cianobatteri… i coralli con la loro attività filtrante possono invece utilizzare il ferro legato alla sostanza organica disciolta. Considerate anche che gli UVA emessi dalle lampade attiniche riducono il ferro facendolo tornare disponibile… L’ossigeno emesso nella zona delle radici (rizosfera) protegge inoltre la pianta dall’acido solfidrico (H2S) che è una delle peggiori tossine che possono formarsi in un substrato anaerobico. Alcuni batteri specifici utilizzano l’ossigeno per ossidare l’H2S in solfati non tossici. Questa ossidazione è un processo batterico comune e fornisce una notevole protezione alle piante acquatiche nei confronti dell’H2S [10]. NUTRIZIONE -Abbiamo visto che le piante emerse sono avide di ammoniaca, e che terminata questa iniziano a consumare i nitrati, all’appello restano i nitriti. Il fatto che l’N venga eliminato al primo passaggio del suo ciclo già dovrebbe determinate una bassa concentrazione di nitriti in vasca perché i batteri Nitrosomonas (che ossidano l’ammoniaca) sono in diretta competizione con le piante emerse e hanno sicuramente la peggio visto la quantità di NH4 che una pianta può immagazzinare e usare in seguito. In compenso i batteri del tipo Nitrospira marina che ossidano i nitriti in nitrati sono avvantaggiati dall’ossigeno immesso nel sistema dalle radici. Il potere filtrante di una mangrovia “sana” in acquario è straordinario: divora l’ammoniaca, divora i nitrati, ossigena i batteri per “cucinare” i nitriti e renderseli appetibili come nitrati… e ossigenando il fondo i batteri anaerobici della denitrificazione sono svantaggiati. Si… favoloso, ma merita un paio di considerazioni. Un gruppetto di sane mangrovie in sump può dare questi risultati, ma ricordatevi che in natura l’ecosistema si basa sulla pianta e in acquario certo non si comporterà come ospite. In una situazione come quella sopra avrete pochi batteri che producono nitriti e tanti che producono nitrati, in questo equilibrio la mangrovia non è un’optional a piacimento: è il motore del sistema, se muore o si ammala avrete squilibri in vasca esattamente come quando vi si rompe lo schiumatoio. Fa una bella differenza se le sue radici ossigenano la sump, oppure se sono nel vostro DSB, pensatele col metodo Jaubert… questi sono metodi che si basano sul fondo come filtro, immaginate che enormi variazioni avrebbero sotto l’influenza di una pianta superiore.
In mia opinione usare le piante superiori come filtri è un’ottima soluzione per le vasche con metodo naturale, e più sono grandi le piante filtranti maggiore può essere il litraggio della vasca. Quale fondo usare, e usare la vasca principale o sump dipende anche da quale pianta superiore di desidera usare, la mangrovia è l’unica conosciuta dagli acquariofili ma in natura ce ne sono tante, alcune più facili da gestire che un’albero tropicale. Spesso in certe vasche si ha un’accumulo di nutrienti, e gli acquariofili impazziscono a sistemare i valori, capita di avere un’infestazione di alghe filamentose orribili e avere i nitrati e nitriti a posto… si da la colpa ai test non buoni, o alle mille cose che possono capitare nei complicati equilibri della vasca… tra i quali c’è anche il fatto che l’ammonio inibisce l’assorbimento e l’assimilazione di nitrati in diversi organismi [11]. Ad esempio le alghe non assorbono i nitrati se la concentrazione di ammonio è superiore a 1 microequivalente (0,018 mg/L) [12]. Questo valore è così piccolo da non essere rilevato in vasca con comuni test casalinghi. Questo spiega perché si può avere un’infestazione di alghe filamentose orribili e i valori a posto: le micro e macroalghe si stanno nutrendo dell’ammonio di cui neppure ci curiamo, preferendolo ai nitrati che possono restare più o meno stabili a seconda della concentrazione di ammonio. Se il pesce di troppo (la fonte di ammonio) mantiene il valore di NH4 per esempio a 0,02 questo col tempo influenzerà l’accumulo di nitrati in vasca perché non verranno più assorbiti da nessuna alga, microalga o zooxantella.
Affidarsi ai soli batteri è impossibile (infatti si usa lo skimmer per eliminare N ancora in forma organica) ed è difficile valutare se la denitrificazione dei batteri è maggiore della nitrificazione. Il potere inibitore dell’ammonio sull’assorbimento dei nitrati non è affatto da sottovalutare: per far scattare l’inibizione basta un’attimo nel vero senso della parola, raggiunta la soglia l’effetto è immediato in circa 1 minuto (è dovuto alla depolarizzazione della membrana e all’inibizione della pompa di estrusione di H della membrana da parte dell’NH4.. L’inibizione osservata successivamente e che richiede almeno un’ora può essere dovuta alla repressione della nitrato riduttasi) ma attenzione che le alghe e le piante acquatiche sommerse ricominciano ad assorbire nitrati uno o due giorni dopo che tutto l’ammonio è stato eliminato dall’acqua, uno squilibrio non da poco. Tenere in vasca qualche macroalga è certamente un grande aiuto perché assorbirebbe l’ammonio. Una Caulerpa o una Halimeda danno più vantaggi che controindicazioni, cosa volete che sia la fatica di contenerle rispetto a valori di ammonio che non vedete e scatenano l’inferno in vasca? Tutto sommato le macroalghe sono soggette a queste inibizioni, mentre le piante superiori (di terra) come le Mangrovie azzererebbero velocemente tutti i valori e accuserebbero ancora un certo appetito…
Le piante e l’assorbimento di metalli pesantiI metalli pesanti sono tossici per tutti gli organismi, sia che si tratti di micronutrienti necessari (zinco, rame, ferro, manganese, nichel…) sia che si tratti di sostanze inquinanti per l’ambiente (alluminio, piombo, mercurio…). Utilizzando per le nostre vasche acqua di osmosi l’apporto di metalli pesanti con i cambi è zero, ma questi arrivano in vasca tramite l’alimentazione dei pesci, l’utilizzo di alcuni integratori per la triade, di alghicidi e antibiotici o prodotti per i cianobatteri se usati, e non da sottovalutare, tutto quello che è nell’aria e che si deposita sulle nostre vasche “aperte” 24 ore su 24.
Altro esempio la nicotina è solubile in acqua ed è un veleno che agisce sul SNC anche dei pesci, se vostro figlio adolescente fuma vicino all’acquario è probabile trovare tracce di nicotina e altre sostanze derivate dalla combustione in vasca. Questo solo per dire che le fonti inquinanti tossiche sono sempre in agguato.
Le piante acquatiche assorbono velocemente i metalli pesanti, la velocità di assorbimento dipende dal metallo e dalla specie di pianta, ma in tutti i casi la velocità è maggiore rispetto a qualunque alga. Per esempio la Elodea nuttalli (acqua dolce) assorbe rapidamente rame e zinco: nell’arco di due ore le radici esposte a 3,2 ppm di zinco accumulano più di 1000 mg/kg di zinco, mentre le foglie ne accumulano circa 300 mg/kg. L’assorbimento dei metalli è passivo e cresce con l’aumentare dei metalli in soluzione [16], è anche dimostrato che l’assorbimento dei metalli ha poco a che vedere con le esigenze di nutrienti delle piante: li assorbono e basta.
BIBLIOGRAFIA[1] Boston HL, Adams MS, and Madsen JD. 1989. Photosynthetic strategies and productivity in aquatic system. Aquat. Bot. 34: 27-57 |

Continua a pagina: 1 2
Messaggio precedenteBetta sp Mahachai. Allevamento e riproduzione
Next PostPlafoniera per T5 fai da te