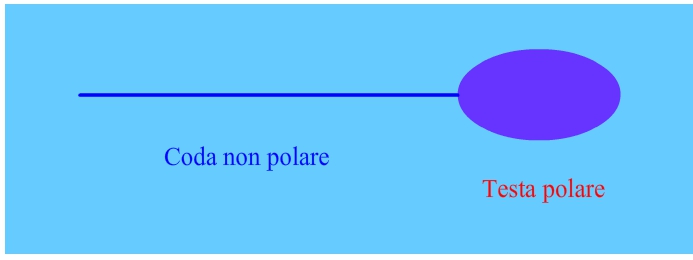
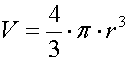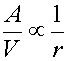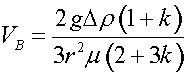Esistono tantissimi schiumatoi in commercio e ognuno funziona secondo una propria filosofia diversa. Su che base facciamo le considerazioni che ci permettono di acquistare lo schiumatoio migliore? In questo articolo si tenta di analizzare in maniera semplificata i fenomeni che permettono agli schiumatoi di funzionare e cosa teoricamente viene fatto per massimizzarne la resa, fornendo al lettore spunti di riflessione e lasciando a lui anche eventuali conclusioni. Si vedrà inoltre cosa viene estratto e cosa invece rimane in soluzione. Perchè alcune molecole possono essere estratte con l’uso di semplici bolle? Prendono il nome di surfactanti, ovvero tensioattivi, non solo le proteine, ma più in generale le molecole organiche a base carbonio e idrogeno. Esse tendono ad accumularsi sull’interfaccia e a modificare la tensione superficiale delle bolle. L’interfaccia è l’area di contatto tra due sostanze. Quando questa si trova tra due sostanze in fasi diverse, ad esempio acqua e aria, viene usulamente chiamata superficie di interfaccia. I surfactanti sono molecole anfifiliche, cioè hanno due parti distinte, una polare e una non polare. Il risultato è che il surfactante, all’atto pratico, ha una parte idrofila (quella polare che viene attirata dalle molecole d’acqua tramite lagami ad idrogeno) e una parte idrofoba (quella non polare che viene respinta dall’acqua e attirata invece dall’interfaccia). Schematicamente sono spesso rappresentati come una testa polare seguita da una coda non polare. La coda è solitamente una catena di idrocarburi, fluorocarburi o silossani, mentre la testa polare può essere sia un composto ionico che un composto non ionico.
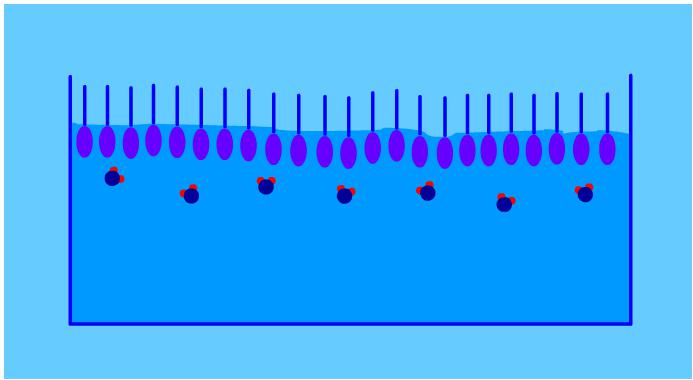
Dal momento che i surfactanti hanno sia una parte idrofila che una parte idrofoba, il posto che permette loro di annullare la risultante delle forze di attrazione e repulsione con l’acqua è la superficie di interfaccia tra acqua e aria. Le molecole anfifiliche tendono dunque a disporsi con la parte polare immersa in acqua, aggrappata ad essa per mezzo dei legami ad idrogeno, mente la coda non polare rimane all’aria. Queste molecole sono poi più o meno idrofile o idrofobe a seconda del tipo; solo le molecole abbastanza idrofobe vengono attirate sufficientemente dall’interfaccia per aggrapparsi ed essere asportate per mezzo della schiumazione.
Quante molecole possono disporsi all’interfaccia? La risposta è per fortuna abbastanza semplice ma poco confortante: solo un singolo strato può disporsi sulla superficie, la quale viene rapidamente occupata dai surfactanti in maniera totale, gli altri sono costretti a rimanere in soluzione. Le proteine, del resto, hanno la parte idrofoba nella parte interna della molecola e quindi rimangono in soluzione facilmente. Una volta che la proteina viene in contatto con l’aria, può cambiare forma ed esporre la parte idrofoba in modo che possa uscire dall’acqua. Risulta quindi chiaro che maggiore è la superficie di interfaccia e maggiore è il numero di surfactanti che possono rimanervi intrappolati. Il metodo più facile per creare una superficie di contatto molto estesa all’interno dell’acqua, è quella di creare molte bolle di dimensioni estremamente piccole. Più è piccolo il raggio delle bolle e maggiore è l’area di interfaccia a parità di volume d’aria generato. Analizziamo infatti le espressioni di area e volume di una sfera:
Se mettiamo in rapporto l’area e il volume delle sfere, e quindi delle bolle d’aria
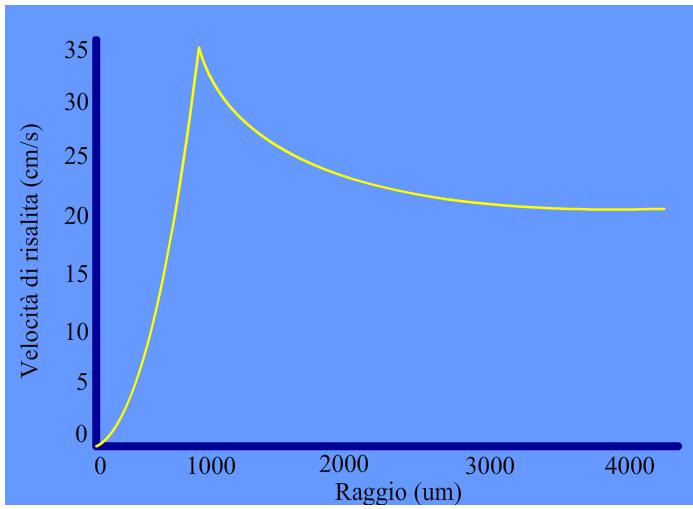
vediamo che se il raggio delle sfere cala, il rapporto tende a crescere sempre di più mano a mano che r cala. Quindi più le bolle sono piccole, più la superficie di interfaccia è elevata a parità di volume totale delle bolle. Non si può comunque pensare di generare una quantità di aria troppo elevata poichè esiste fisicamente un limite superiore a questa quantità. Questo limite dipende dalla densità dell’acqua ed è fissato al 13% in volume di aria rispetto all’acqua per una densità pari a quella dell’acqua marina. Se si eccede oltre questa quantità, avviene quello che si chiama bubble merging, ovvero le bolle risultano troppo vicine e si uniscono le une con le altre, dando origine a bolle più grosse vanificando di fatto lo sforzo per ottenere una vasta superficie di contatto. Un altro vantaggio che si ha ad avere bolle piccole è dato dal tempo di risalita. I vari tipi di surfactanti hanno diversi gradi di idrofobia e quindi alcuni hanno bisogno di più tempo per aderire all’interfaccia di altri. A questo aggiungiamo che la velocità di diffusione di queste molecole all’interno dell’acqua è molto bassa e quindi sono dotate di scarsa mobilità. La bolla deve stare a contatto con il liquido per il tempo necessario a caricarsi completamente di surfactanti prima di finire la sua corsa. Un tempo troppo lungo non è tuttavia consigliabile poichè i surfactanti con una più forte parte idrofoba prenderebbero lentamente il posto di quelli più deboli, rimandandoli in soluzione. Di seguito possiamo vedere un grafico che mette in relazione il raggio di bolle pulite (cioè non ancora ricoperte di surfactanti) con la loro velocità di risalita. I dati trovati da molti autori (Leifer et al. 1999, Clift et al. 1978, TMB 1963, Datta et al. 1950, Miyagi 1925) corrispondono con buona approssimazione, quindi si riporta un andamento qualitativo.
La velocità di risalita è condizionata anche dalla temperatura, ma nel caso di schiumatoi per acquari la si può ritenere una costante. In generale però, essa modifica l’idrodinamica della bolla alterando la viscosità e la densità del fluido. Come si può vedere dal grafico, più piccole sono le bolle, minore è la velocità di risalita. La velocità può essere calcolata con la relazione di Hadamard-Rybczynski che è una estenzione della legge di Stoke per bolle a superficie sferica.
Questa tiene conto anche di bolle a superficie mobile. Accade infatti che, oltre i 750 micron di raggio, la bolla cominci a perdere la propria sfericità e ad oscillare durante la risalita. Se il raggio aumenta ancora, la bolla oscilla sempre più velocemente mentre la velocità di risalita diminuisce… ma a questo punto la bolla è già troppo grande e vengono meno tutti i presupposti di massima superficie di interfaccia. Dunque le bolle devono essere più piccole possibile per mentenere un’ alta superficie d’interfaccia e rimanere a contatto con l’acqua per un tempo sufficiente. E’ possibile misurarle? E’ molto difficile stabilire la grandezza di una bolla solo guardandola, per questo sono state ideate 3 tecniche: Metodo Ottico Vediamo inoltre che nella equazione compare un termine k. Questo può variare da zero ad infinito e indica se la bolla è ancora pulita (zero) o è già interamente ricoperta da surfactanti (infinito). La conclusione è che anche i surfactanti che ricoprono la bolla ne modificano la velocità di risalita. In particolare una bolla “sporca” sale più lentamente di una bolla “pulita”. Vediamo ora come si comportano i surfactanti sulla superficie di una bolla in movimento relativo con l’acqua. Quando la bolla ha velocità relativa non nulla rispetto all’acqua che la circonda, stia essa risalendo verso la superficie oppure sia in moto turbolento all’interno della camera di contatto, i surfactanti vengono spinti verso la parte posteriore dal flusso di acqua che lambisce la bolla stessa. La situazione di equilibrio si ha quando le forze di repulsione tra surfactanti uguagliano la forza che li spinge verso la parte opposta al moto. Come situazione limite si ha che i surfactanti si radunano tutti nella parte bassa della bolla.
Come detto prima inoltre, esistono molecole con diversi gradi di idrofobia e quindi diverse forze che li spingono a rimanere attaccati alla bolla. Il moto turbolento e la troppa velocità relativa tra bolle e acqua, impediscono alle molecole meno idrofobe di attaccarsi alla bolla. La ridotta velocità di diffusione dei surfactanti, però, spinge a creare un dolce movimento tra acqua e bolle atto solo ad aumentare la probabilità che queste molecole entrino in contatto con la superficie di interfaccia. La bolla quindi deve avere una giusta velocità relativa che massimizzi la probabilità di farla incontrare con i surfactanti ma che non sia troppo elevata rendendone difficile l’ancoraggio, o peggio strappando i surfactanti già ancorati. Risulta a questo punto chiaro che molto di quello che accade in uno schiumatoio si riduce ad una questione (seppur complessa) probabilistica e, pertanto, si deve agire nel senso di massimizzare la probabilità che ciò accada. Questo lo si ottine solo facilitando i processi fisici che hanno luogo microscopicamente. Riassumendo quello che abbiamo visto fin qui toricamente, le regole per massimizzare l’effcienza della schiumazione sono fondamentalmente 3: Massimizzare la superficie di interfaccia tra acqua e aria. Questo lo si può fare solo creando più bolle possibili e di diametro il più piccolo possibile, sempre rimanendo entro il 13% di rapporto aria/acqua per la densità dell’acqua marina. Creare un tempo di contatto che non sia troppo basso ma neppure troppo alto. In questo modo la bolla si ricopre completamente di surfactanti di tutti i tipi. Creare una giusta velocità relativa tra bolla e acqua in modo da permettere anche alle molecole attratte più debolemnte di ancorarsi e di rimanere agganciate fino alla fine della corsa della bolla stessa. Ma quali sono i composti che riusciamo ad estrarre con l’uso dello schiumatoio? Quali quelli che invece non si riescono a togliere? Va innanzitutto detto che il termine “schiumatoio di proteine” è alquanto riduttivo e ovviamente gli schiumatoi che usiamo non asportano solo proteine. Il nome che gli è stato dato trae molto in inganno e, spesso, anche molti produttori pensano che lo schiumatoio asporti solo proteine e poco altro. Sentiamo spesso parlare di DOC (Dissolved Organic Carbon), questa parola riassume il concetto di composto organico che, come abbiamo detto all’inizio, contiene oltre ad altri elementi atomi di carbonio e atomi di idrogeno. Un accumulo di queste sostanze può inibire i batteri nitrificanti e incrementare la richiesta di ossigeno. Solo alcuni tipi di DOC sono degradati dai batteri in sostanze come ammonio e diossido di carbonio, consumando ossigeno durante il processo. Si può poi accennare al DON (Dissolved Organic Nitrogen) e al DOP (Dissolved Organic Phosphorus), rispettivamente composti organici conteneti azoto e fosforo. Per tornare alla domanda che ci siamo appena posti, lo schiumatoio rimuove virtualmente tutte le molecole idrofobe o anfifiliche che comprendono si le proteine, ma anche amminoacidi, vitamine, carboidrati, grassi, DNA ecc… Sono compresi anche i composti organici che sono responsabili dell’ingiallimento dell’acqua e anche le tossine emesse dai coralli. Possono essere rimosse indirettamente anche sostanze che sono legate a quelle organiche come alcuni metalli. Quelle che non possono essere schiumate invece, sono tutte quelle molecole che sono legate fortemente all’acqua e che quindi non riescono a rimanere attaccate alle bolle. Quasi tutti i composti inorganici sono altamente polari e quindi non vengono attirati dalle bolle. L’unico modo perchè questi composti vengano schiumati è che siano legati ad altri, che invece sono attirati dall’interfaccia, come il rame per esempio, che è molto spesso legato a molecole organiche. Sfortunatamente, nitriti, nitrati e fosfati sono composti inorganici con un legame molto forte con l’ acqua e quindi non possono essere schiumati. Azoto e fosforo possono essere invece schiumati quando fanno parte di molecole organiche: il fosforo è contenuto in molte molecole organiche come ad esempio i fosfolipidi, il DNA e molte proteine. Queste vengono poi a loro volta elaborate e danno luogo ai fosfati inorganici che non sono attirati dall’ interfaccia acqua/aria. Rimuovere i composti organici che contengono fosforo, è il modo principale per abbattere i fosfati inorganici utilizzando lo schiumatoio. Ci sono poi molte controversie su che fine faccia lo iodio. Tutte le forme presenti in acquario sono inorganiche e quindi non dovrebbero essere rimosse direttamente in quantità considerevoli. Tuttavia alcuni studi confermano che nel liquido schiumato, lo iodio sia presente in percentuale maggiore rispetto alla concentrazione in acqua marina, per cui ci devono essere altri meccanismi che ne permettono l’ asportazione. Sono state fatte alcune ipotesi ma non sono ancora state confermate. Come conclusione possiamo dire che, mentre la teoria dei surfactanti è riconosciuta ufficialmente dalla scienza ed è tutt’ora al centro di studi di famose università per la ricerca di nuovi materiali, tra cui anche il famoso cotone idrorepellente, le applicazioni per la schiumazione sono tra le più disparate e seguono filosofie anche in netto contrasto tra loro. La conoscenza dei concetti di base è comunque utile ad acquisire quella consapevolezza che ci aiuta nella scelta delle apparecchiature. |