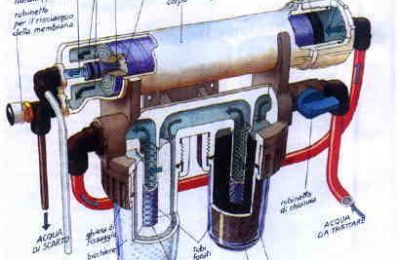
L’importanza della durezza carbonatica è legata agli equilibri multipli che si instaurano tra anidride carbonica, presente in acqua anche come acido carbonico H2CO3, bicarbonati e carbonati, che possiamo schematizzare come: – anidride carbonica + acqua = acido carbonico; O, in formule, come: – CO2 + H20 <—-> H2CO3 – H2CO3 <—-> H+ + HCO3- – HCO3- <—-> H+ + CO3^2- Avremo quindi a che fare con una serie di equilibri che definiranno le quantità di ciascuno degli ioni pre-senti in soluzione, in quanto il rapporto tra le concentrazioni delle specie a destra e a sinistra del segno di equilibrio a sarà costante. Se ad esempio si satura l’acqua con anidride carbonica, si avrà che: Analogamente, se sì pongono in una soluzione sufficientemente acida degli ioni carbonato, parte di essi reagirà con gli ioni Idrogeno formando ioni bicarbonato in quantità tale da soddisfare l’equilibrio carbo-nato/bicarbonato. Gli ioni bicarbonato formato si metteranno in equilibrio con l’acido carbonico indissociato, reagendo in parte con gli ioni idrogeno ancora presenti. In tal caso le reazioni di equilibrio andranno lette da destra a sinistra e l’instaurarsi degli equilibri avverrà consumando ioni H+ presenti in soluzione: il pH si innalzerà e la soluzione diventerà basica.
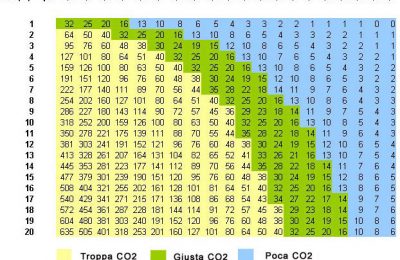
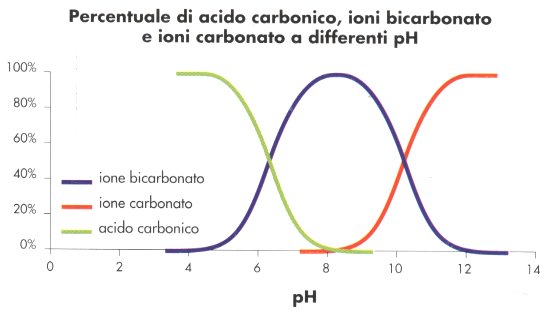
Il pH di un’acqua sarà quindi fortemente legato alle concentrazìoni di ione carbonato e bicarbonato: ad ogni valore di acidità corrisponderà una quantità diversa di tali specie in soluzione. Nel disegno in questo box sono riportate le percentuali di carbonati, bicarbonati e acido carbonico in funzione del pH. L’acquario di acqua dolce è normalmente mantenuto a un pH intorno a 7, a tale pH la specie predominante sarà quindi lo ione bicarbonato. Il sistema anidride Carbonica/acido Carbonico/ioni bicarbonato/ione carbonato si adatterà ad ogni variazione di pH, spostando i suoi equilibri nella direzione più opportuna: verso destra se la concentrazione ioni H+ è diminuita e verso sinistra se, al contrario, è aumentata. il modificarsi di tali equilibri come conseguenza di una variazione dì pH comporterà quindi la produzione di nuovi ioni H+ (nel caso in cui il pH tenda ad aumentare) o al contrario il consumo di parte degli ioni H+ in eccesso (nel caso in cui il pH tenda a diminuire): in tal modo le variazioni di acidità vengono assorbite e rese minime dal sistema, definito in base a tale comportamento “sistema tampone”. Il sistema CO2/H2CO3/HCO3/CO3^2- è il più importante dei sistemi tampone presenti dell’acqua: la comprensione del suo funzionamento è di estrema utilità nella conduzione di un acquario. Questo articolo è stato pubblicato sul numero 22 – Luglio 2000 – della rivista “il mio acquario” la quale ha concesso tale ripubblicazione. |
Messaggio precedenteUn lago in casa vostra - Informazioni sui ciclidi del lago Malawi
Next PostZeovit - Considerazioni dopo due mesi di utilizzo