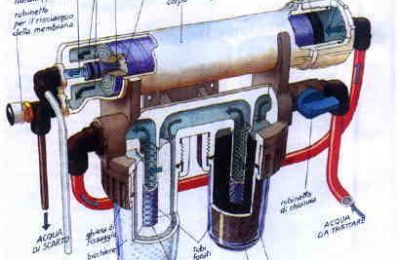
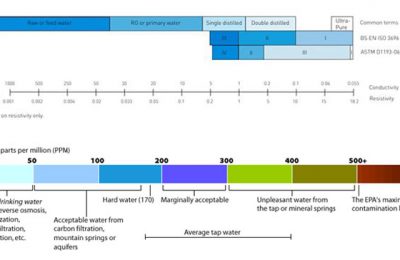
La concentrazione degli ioni H+ in un acqua (in realtà lo ione idrogeno esiste in forma legata ad una molecola d’acqua, cioè come H30+, ma per semplicità considereremo la specie libera, H+) determina la sua acidità, definita mediante una grandezza adimensionale, il pH. Proposto nel 1909 dal chimico danese Sorensen, il pH (dalle iniziali della definizione latina pondus Hydrogenii) rappresenta il logaritmo negativo della concentrazione degli Ioni idrogeno presenti in soluzione: pH = – log10 (concentrazione H+) La scala di pH si basa sulla ionizzazione spontanea dell’acqua: nell’acqua, infatti, oltre alle molecole non dissociate (H2O) esisteranno molecole dissociate negli ioni H+ e OH-, secondo la reazione, detta di autoprotolisi: H2O <—-> H+ + OH- Questa è una reazione di equilibrio, cioè avverrà nei due sensi della freccia, mantenendo costanti le quantità di ioni prodotti. Ciò significa che la somma degli ioni H+ e OH- presenti nell’acqua sarà sempre pari ad un valore costante. Tale valore può essere definito come somma delle concentrazioni dei due ioni, espresse mediante funzioni logaritmiche in unità di pH per lo ione H+ e di pOH per lo ione OH-. Esso viene indicato come pKw e il suo valore è pari a 14, influenzato solo leggermente dalla temperatura: pKw = pH + pOH = 14 Se uno dei due ioni è presente in eccesso, esso reagirà con una uguale quantità di ioni dell’altro segno (la reazione procederà verso sinistra) fintanto che la somma delle loro concentrazioni residue non dia esattamente un valore di pKw uguale a 14. Alla luce di tale definizione il valore del pH in una soluzione acquosa diluita potrà quindi assumere valori compresi tra O e 14. pH = pOH = _ pKw = 7 La concentrazione di ioni H+ sarà circa di 10^-7 grammi per litro di acqua (che corrisponde a 0,0001 mg/l), definita (mediante la sua funzione logaritmica cambiata di segno) in unità di pH, come: pH = – log10 10^-7 = 7 Avremo quindi un pH pari a 7 e l’acqua sarà detta neutra (e in effetti l’acqua sarà complessivamente neutra, contenendo uguali quantità di Ioni H+ carichi positivamente e ioni OH- carichi negativamente, derivanti dalla sua dissociazione). Se un’acqua contiene sostanze acide, cioè sostanze in grado di rilasciare in soluzione altri ioni H+, la concentrazione di questi sarà maggiore che nell’acqua distillata e il pH si abbasserà. Se ad esemplo la concentrazione complessiva di Ioni H+ è pari a 10^-5 g/l (0,01 mg/l) si avrà: pH = – logl0 10^-5 = 5 pH sarà quindi 5 e l’acqua sarà acida, contenendo un eccesso di ioni H+. In tale situazione, dovendo restare costante la somma delle concentrazioni degli Ioni H+ e OH-, la quantità di Ioni OH- sarà, espressa In pOH, pari a 9, corrispondente a una concentrazione molto inferiore a quella presente nell’acqua distillata. pH = – log10 10^-9 = 9 il pH corrispondente sarà quindi 9 e la soluzione si dirà basica. A tale valore di pH corrisponderà un pOH pari a 5, cioè una concentrazione di ioni OH- maggiore che nell’acqua distillata.
Questo articolo è stato pubblicato sul numero 22 – Luglio 2000 – della rivista “il mio acquario” la quale ha concesso tale ripubblicazione. |
TAGph
Messaggio precedenteUn lago in casa vostra - Informazioni sui ciclidi del lago Malawi
Next PostZeovit - Considerazioni dopo due mesi di utilizzo