In questa seconda parte parleremo dei metodi migliori per fornire calcio al nostro acquario e tutti i calcoli e le misure necessarie per farlo, senza costringervi a copiare pedissequamente dei dosaggi di cui non conoscete affatto il significato. Un po’ più laborioso, ma vedrete che capire corrisponde ad agire e non obbedire ciecamente.
Kalkwasser
E’ questo uno dei più antichi e collaudati sistemi di integrazione sia di calcio che alcalinità, eppure risulta essere ancora uno fra i più fraintesi e, qualche volta, fra i più pericolosi.
Abbiamo già visto nella prima parte che dosare troppo e troppo velocemente la kalkwasser all’interno di un sistema chiuso può condurre ad una massiccia precipitazione di carbonati, oltre che di calcio, magnesio e stronzio, conducendo il sistema in un punto di instabilità critica, visto che l’alcalinità della vasca entra in gioco, come abbiamo già detto, con la stabilità del suo pH.
La kalkwasser come si sa è stata adottata molti anni orsono da Peter Wilkens un acquariologo di fama, che mise in atto questo espediente per fornire calcio, e contemporaneamente alcalinità, ad una vasca di barriera. Dovrebbe essere del tutto chiaro oramai che la precipitazione biotica all’interno dei coralli ( quella abiotica è quella senza l’intervento di cellule viventi, come quella che accade per esagerazione di materiali carbonatici in soluzione) abbisogna anche di idrogeno carbonato (HCO3-) oltre che di calcio per costruire lo scheletro calcareo.
Il principio è semplice si aggiungono 3 grammi (per una soluzione non sovrasatura come questa basta mettere solo 1 grammo. Alcuni pensano che la soluzione sovrasatura sia più efficace.) di Ca(OH)2, chiamato idrossido di calcio, per ogni litro di acqua dolce e non salata. Questo perché i minerali e i carbonati presenti nell’acqua salata farebbero precipitare tutto rendendo la soluzione inutile.
Infatti l’idrossido di calcio reagisce così repentinamente da essere considerato in soluzione una sostanza altamente instabile. Quando, infatti, sciogliamo il soluto all’interno dell’acqua la massiccia presenza di gruppi OH (ossidrilici), come abbiamo già visto, innalza il pH della soluzione fino a valori molto basici intorno a 12,5.
Questo perché i gruppi OH fungono da basi che accettono i protoni di idrogeno H+, che invece abbassano il pH. Quindi maggiore la concentrazione di OH maggiore sarà il pH e viceversa maggiore la concentrazione di H+ e minore sarà il valore del pH, cioè più acido. Vi ricordo che il pH è considerato acido sotto il valore della neutralità e cioè 7, e basico al di sopra di tale valore.
Ma perché quando metto in soluzione il Ca(OH)2 devo essere cauto a non agitare troppo forte e a chiudere subito dopo la soluzione che dovrà essere subito usata, altrimenti pena la sua totale inutilizzazione???
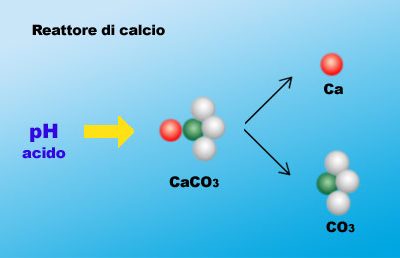
Facciamo un passo indietro non appena il Ca(OH)2 si miscela con l’acqua, il pH schizza in alto e il sistema poiché è uscito fuori dalla sua omeostasi o equilibrio, tenderà immediatamente di tamponare tale mutamento repentino assorbendo all’interno, attraverso il pelo dell’acqua, dall’ambiente circostante l’anidride carbonica (CO2) che tenderà per sua natura a riabbassare il pH verso valori più normali secondo la reazione CO2 +H2O <> H2CO3 che è acido carbonico.
Ma come abbiamo sottolineato più volte se l’aumento di OH è troppo veloce e troppo repentino il sistema non riesce a bilanciare in tempo tale reazione e porterà alla formazione di carbonati e conseguente precipitazione (vedi parte 1). Quindi il sistema di non agitare troppo la kalk durante la preparazione e il suo inutilizzo dopo pochi giorni è da ricondurre alle reazioni che essa ha con la CO2 che richiamerebbe formando composti carbonatici che si legherebbero al calcio portando alla formazione di CaCO3 che abbiamo visto essere insolubile e inutilizzabile.
Per sapere infatti se la Kalk è ancora utile per fornire Calcio dobbiamo testarne il pH il quale non deve scendere sotto 12, altrimenti la quantità di calcio fornita è veramente irrisoria. Questo è anche il motivo per cui nella parte 1 abbiamo asserito che se si esegue un test per la durezza carbonatica in acqua di osmosi e una base OH- noi avremo un test comunque positivo, anche se in principio non c’era nemmeno un’oncia di carbonati. Infatti la CO2 dell’aria ha reagito con i gruppi OH- per formare carbonati: OH- + CO2 <<>> HCO3- che sono appunto (bi)carbonati, per usare una nomenclatura ormai desueta, anche se ancora utilizzata.
Un’altra accortezza da usare è che la soluzione ottenuta va usata immediatamente e somministrata con sistemi a gocciolamento (una damigianetta con rubinetto, ecc.) o con una pompa dosatrice per evitare, appunto, una improvvisa impennata del pH e quello che comporterebbe.
Kalkwasser e Acido Acetico
Uno dei limiti della Kalkwasser (anche se è un sistema ancora insuperabile per la salute del proprio reef) è il suo legame con l’acqua di rimbocco per l’evaporazione. Negli acquari marini col passare delle ore l’acqua contenuta tende, come sempre accade, ad evaporare. Poiché nell’acqua salata tende ad evaporare solo la parte del solvente (l’acqua) e la concentrazione del soluto rimane costante (NaCl e altri sali), la salinità tenderà ad aumentare progressivamente fino a diventare insostenibile e deleteria per gli abitanti della vasca.
Rammentate che in natura i Reef sono abituati a variazioni leggere della salinità, a causa delle forti evaporazioni per le alte temperature climatiche come per le ingenti precipitazioni che si hanno. Poichè la kalkwasser è legata all’evaporazione, non possiamo immettere più acqua dolce (e quindi kalk) di quanto il sistema ne abbia persa durante il normale processo di evaporazione.
Ma nei sistemi più piccoli, tale evaporazione non è così estesa, a causa della piccola superficie del pelo dell’acqua. Quindi la kalk resterebbe un sistema ancora utilissimo per migliorare la schiumazione e far precipitare i dannosi fosfati, ma non sarebbe sufficiente a immettere abbastanza calcio se la domanda per questo elemento fosse elevata (molte acropore e coralli duri).
Per questo motivo alcuni hanno pensato di sfruttare meglio la kalkwasser immettendo nella soluzione appena preparata con accortezza di non agitarla troppo, una certa quantità di acetito acetico (aceto di vino neutro e non quelli balsamici e particolari) che di solito sono in soluzione al 5- 6 %. Tale stratagemma fornisce una dose in più di CO2 contenuta nella molecola di acetato, fornendo in tal modo una dose suppletiva di anidride carbonica per formare più carbonati.
Personalmente non consiglio questo metodo per una serie di problematiche inerenti, fra le quali un abbassamento del pH e una fonte di carbonio organico (vedi articolo su batteri). Poiché noi utilizziamo la Kalk per sostenere il pH durante l’utilizzo del reattore di calcio e vista già la massiccia presenza di CO2 a causa di ciò, trovo inutile aggiungere una sostanza estranea di cui ancora non sappiamo molto degli effetti sugli invertebrati.
Colgo l’occasione, come ultima istanza, di consigliarvi di non dosare la kalkwasser solo la notte se la usate in congiunzione con i reattori di calcio e per grandi sistemi. Spesso, infatti, chi usa la kalk la dosa durante il periodo di buio per sostenere il pH che naturalmente durante la notte tende a diminuire. In grandi sistemi con forte evaporazione questo tende a far oscillare troppo la salinità fra notte e giorno e anche questo può alla lunga stressare gli abitanti.
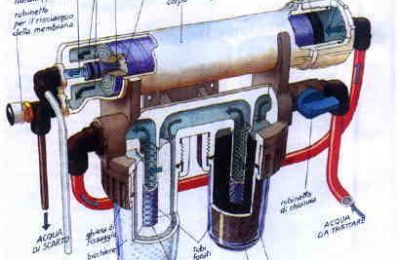
In più la dose massiccia di OH-, concentrata solo entro poche ore, anzichè essere diluita nell’arco delle 24 ore, può essere devastante in termini di precipitazioni se non si usano gli accorgimenti del caso (goccia a goccia) e se si usano altre fonti di calcio, come il reattore. Personalmente noi possediamo un reattore enorme per il nostro reef molto grande e un distributore automatico di kalkwasser che consiglio a tutti ( chiamato reattore di Nilsen) e che viene dosata in tutto l’arco delle 24 ore.
Le fluttuazioni di pH notturno sono minime comunque e se proprio volete sostenerlo di più prendete in considerazione un refugium ad alghe con illuminazione inversa, o come abbiamo fatto noi ad illuminazione continua, per scongiurare il pericolo di innescare il processo di riproduzione sessuata (molto probabile nella Caulerpa con ciclo naturale giorno/notte) che risulterebbe dannosissimo per animali sessili, invertebrati e vertebrati, nella malaugurata ipotesi che si verificasse.
Vi ricordo inoltre che la salinità di un reef è strettamente legata anche alla colorazione dei coralli, soprattutto quelli più delicati come seriatopore, pocillopore e acropore con colori metallici, i quali reagiranno scurendosi se la salinità dovesse salire troppo. Vi consiglio di non farla mai andare oltre i 33 ppt oppure 1024 di densità se doveste sperimentare tale fenomeno e aveste escluso altre cause (troppo cibo e residui organici, troppi oligoelementi, bassa alcalinità, ecc.). Il termine ppt significa parti per mille (parts per thousand) e siccome il grammo è la millesima parte del kilo ( 1 kilo con buona approssimazione è uguale a 1 litro) possiamo dire 33 grammi di sale per litro di acqua, mentre la misurazione 1024 indica la densità. quindi se avete una salinità a 32 ppt e volete portarla a 34 la differenza è 2 ppt, quindi basta aggiungere 2 grammi di sale per litro di acqua che andremo a trattare. Ricordatevi sempre che la densità dell’acqua di mare è strettamente legata alla temperatura, quindi misuratela alla temperatura del vostro acquario.
Il Metodo Balling
Eccoci finalmente al metodo più sicuro, efficace ed altrettanto economico che ci sia al presente. Il reattore di calcio è a nostro avviso la migliore alternativa, ma a causa dei costi elevati e dei modelli truffa che vengono venduti, non è possibile utilizzarlo universalmente e in ogni circostanza. Il Balling, invece, costa poco, è efficace e non è complicato. Prima di cimentarvi nella spesa di un reattore di calcio, vi prego di informarvi molto bene o di chiedere consiglio a qualcuno. Per questo e per tutti gli altri argomenti noi saremo lieti di darvi assistenza con la nostra esperienza.
Prima di procedere dobbiamo dire ancora solo due parole sulle misurazioni chimiche, per essere in grado di capire meglio cosa ci aspetta.
Abbiamo visto in precedenza la misurazione mEq/L. che è millequivalenti su litro. Tale misurazione è molto usata, anche nei laboratori di analisi cliniche umane. E’ semplicemente un metodo diverso di misurare gli elementi chimici in modo più esatto e poiché lo abbiamo già incontrato per l’alcalinità, può essere utile sapere cos’è.
mEq = (mg. x valenza) / peso atomico
mg = (mEq x peso atomico) / valenza
Come si può vedere vengono prese in gioco la valenza e il peso atomico dell’elemento.
Un’altra unità di misurazione chimica è la mole. La mole è il peso atomico in grammi
1 mole = peso atomico in grammi
1 mmole = peso atomico in milligrammi
Ma come si fa a pesare un atomo di calcio???
A questo ha pensato Avogadro, uno scienziato che ha stabilito che siccome è impossibile pesare un atomo, allora possiamo pensare di pesare un volume di atomi. Egli ha scoperto che uguali volumi di gas a temperatura e pressione costante contengono esattamente lo stesso numero di atomi o molecole e cioè 6,022 x 10 elevato alla 23. Un numero enorme con 23 zero.
Quindi il numero di questi atomi o molecole espresso da Avogadro ci dice che è uguale ad una mole che avrà il peso atomico dell’elemento che ci interessa. Quindi nel caso del calcio, una mole di calcio possiede un numero pari a 6,022 x 10 alla 23 ( così come il magnesio, stronzio e tutti gli elementi ) la cui totalità pesa come il peso atomico espresso in grammi. Vi ricordo che il peso atomico è dato in corrispondenza del carbonio 12 ( vedi parte 1 ).
Esempio:
Calcio: 1 mole possiede 6,022 x 10 alla 23 di molecole che pesano 40,08 ( il peso atomico ce lo dice la tavola degli elementi )
1 mole di calcio = peso atomico del calcio espresso in grammi = 40,08 grammi
1 mmole di calcio = peso atomico del calcio espresso in mmg
In definitiva i chimici barano un pochino: poiché è impossibile pesare con una bilancia un atomo di calcio, essi hanno stabilito il concetto di mole che contieno un numero preciso e fisso ( Avogadro ) di molecole o atomi e che pesa quanto il peso atomico dell’atomo che stiamo pesando.
Ora continuiamo!
Supponiamo che il contenuto di calcio nel nostro acquario sia 340 mg/L e che il contenuto ottimale si aggiri intorno ai 400 mg/L. Il nostro acquario avrà un difetto di calcio pari a circa 60 mg/L.
400 mg/L – 340 mg/L = 60 mg/L ( calcio da aggiungere )
Supponiamo che il nostro acquario, dopo il calcolo dei litri netti ( senza rocce e sabbia e compresa la sump ), abbia un litraggio di 600 litri. Abbiamo visto che abbiamo uno scompenso di calcio di circa 60 mg per litro di acqua e quindi per sapere sul volume totale dobbiamo moltiplicare per il litraggio netto della vasca:
60 mg/L x 600 L = 36000 mg = 36 g ( 1000mg = 1 g) (totale di calcio mancante per tutta la vasca).
Il metodo Balling utilizza a questo scopo il reintegro di calcio utilizzando un tipo di calcio il CaCl2 noto come cloruro di calcio. Esistono 3 forme di CaCl2: cloruro di calcio anidro, diidrato e esaidrato. Il primo è la forma più pura e utile, la seconda contiene 2 molecole di acqua ( CaCl2 x 2 H2O ) e il terzo ne contiene 6 di molecole di acqua.
Appare chiaro che maggiore sarà la porzione idrata e minore, a parità di peso, sarà la concentrazione di calcio disponibile. Quindi supponiamo che per tale calcolo il calcio che abbiamo preso ( e che dobbiamo procurarci se possibile ) è quello anidro, che come dice la parola non contiene acqua, quindi è puro. Se doveste utilizzare un altro tipo, come quello diidrato, sarete in grado grazie a questo articolo di fare i calcoli aggiustati. Procediamo.
Ora vediamo di quanti grammi abbiamo bisogno di cloruro di calcio affinchè quel peso mi fornisca i 36 grammi di calcio di cui ho bisogno o i grammi che devo integrare periodicamente.
In una mole di CaCl2 non è presente solo un atomo di calcio ma anche 2 atomi di cloro. Quindi ogni mole di CaCl2 mi fornisce un atomo di calcio e 2 di cloro. Abbiamo detto che una mole di calcio pesa circa 40,1g e vediamo che il cloro pesa 35,5 g (sempre nella tavola degli elementi). Quindi:
Cl x 2 = 35,5 x 2 = 71g
Ca2+ = 40,1g
71g + 40,1g = 111,1g (peso di una mole di CaCl2)
Se avessimo usato CaCl2 x 2H2O (cloruro di calcio diidrato) avrei dovuto aggiungere anche il peso delle 2 moli di acqua:
H2 = 2g ( peso atomico dell’idrogeno circa 1,008 x 2 volte )
O = 15,9994 circa 16g
H20 = 2+16 = 18g
2H2O= 18×2 = 36g
Tutto chiaro?! Ok procediamo.
Ora sappiamo che in 111,1g di CaCl2 anidro sono presenti 40,1g di calcio e che per avere la stessa quantità di calcio, se avrò il CaCl2 diidrato ne avrò bisogno di 147,1g (111,1 + 36).
Nel nostro esempio di prima abbiamo visto che per reintegrare il calcio nella mia vasca avevo bisogno di 36 grammi di calcio. Una semplice proporzione ci toglierà fuori dall’imbarazzo:
111,1grammi di cloruro di calcio anidro contengono 40,1 di calcio elemento come X di cloruro di calcio anidro contengono 36 grammi di calcio elemento
111,1g : 40,1g = X : 36g (per quello che concerne il cloruro di calcio anidro CaCl2)
X = (111,1 x 36): 40,1 = 99,74
[ 147,1g : 40,1g = X : 36g (CaCl2 x 2 H20 cloruro di calcio diidrato) ]
Questa è quindi la quantità di Cloruro di Calcio che dobbiamo fornire per reintegrare il Calcio che dovevamo. Il cloruro di calcio, a differenza della kalk, può essere mischiato liberamente e conservato in grandi recipienti, poiché la sua conservazione è pressochè illimitata, essendo una soluzione stabile e ha un’elevatissima solubilità in acqua.
Ma come avrete notato per ogni atomo di calcio che fornisco, aggiungo al sistema anche 2 atomi di cloro. Poiché il cloro è l’elemento più abbondante nell’acqua marina, essendo il costituente del cloruro di sodio, il sale marino (NaCl), questo non ci preoccupa molto all’inizio e se la cosa è saltuaria, poiché la deviazione dello ione cloro in soluzione è esigua rispetto alle sue concentrazioni e con dei cambi parziali di acqua che settimanalmente facciamo.
Ma a lungo andare questo può provocare una deviazione ionica dell’acqua che può causare problemi per degli esseri che sono abituati a vivere in ambienti ionicamente stabili da milioni di anni. Quindi se usate questo metodo per correggere la concentrazione di calcio solo in emergenza non preoccupatevi del resto dell’articolo. Se invece fate come molti, che utilizzano da sempre questo metodo affidabile come unico per reintegrare il calcio in modo cospicuo e preciso, allora dovete continuare a fare i piccoli chimici ancora per un po’.
Quindi fin qui abbiamo visto qual’è il modo esatto per calcolare la massa di cloruro di calcio (nelle sue forme) per aggiungere una quantità nota di calcio di cui si ha bisogno.
Ora dobbiamo calcolare la quantità di NaHCO3 (idrogeno carbonato di sodio o bicarbonato) o di Na2CO3 (carbonato di sodio o soda. Per semplicità faremo i calcoli solo per il primo, ma si può utilizzare anche questo altro composto che ha un impatto sul pH alzandolo un pochino, mentre il NaHCO3 a lungo andare lo deprime un po’. Quindi vedete voi, anche se in un Reef di solito il pH va di solito sostenuto. I calcoli per il secondo sono semplici se sapete fare i primi).
Ma perché dobbiamo aggiungere il bicarbonato o la soda?? Per fornire alcalinità, affinché i coralli per precipitazione biotica possano assieme al calcio formare dentro di loro il carbonato di calcio necessario per depositare lo scheletro per la crescita. Allo stesso tempo il sodio contenuto in entrambi i composti assieme al cloro del cloruro di calcio formerà NaCl che è il sale, senza deviare l’equilibro ionico. Quello che si innalzerà a lungo andare sarà la salinità che può essere corretta, aggiungendo dell’acqua di osmosi con un sale senza la porzione di NaCl.
Questi sali si possono trovare in commercio (come la Tropic Marine) o come abbiamo fatto noi, lo potete comprare insieme al calcio e al magnesio in Germania per pochi euro o in farmacie specializzate. Di solito il magnesio noi lo abbiamo trovato sempre esaidrato, mentre il calcio anidro. Anche queste soluzioni sono facilmente preparabili in grandi contenitori per essere conservati.
Durano nel tempo. La cosa importante è di non mischiare mai i contenuti fra loro e di attendere qualche ora dalla somministrazione di uno dall’altro (minimo mezz’ora) per non far precipitare i composti. Noi ad esempio abbiamo in passato usato damigiane da 20 litri ognuna, contenenti una il cloruro di calcio anidro, una il magnesio esaidrato (per i calcoli sapete già come fare), un’altra con soda (Na2CO3) e l’altra con il sale senza NaCl. Potete aggiungere la vostra dose a intervalli di mezz’ora l’uno dall’altro o prendere delle pompe dosatrici multicanale per lo scopo, fornendo in tal modo una piccolissima quantità costante durante tutte le 24 ore, badando a non far cadere le soluzioni nello stesso punto della sump, ma separate. Un altro metodo può essere quello di usare sacche per le flebo di circa 5 litri ognuna che appese alla sump in punti diversi forniscono per gocciolamento le soluzioni. Badate a non sovradosare, poiché conoscete il modo per calcolare, e a far cadere le soluzioni in punti diversi se gocciolano, o in tempi distanti (minimo mezz’ora) se la quantità è cospicua.
Ricordatevi che non è mai consigliabile aumentare il calcio più di 5 mg/l per ogni 100 litri di acquario o 0,25 mEq/l (1 KH) per ogni 100 litri, in 24 ore. Quindi se avete un acquario di 500 litri potete salire a 25 mg/l di calcio e 1 mEq/l (2,8 KH) per l’alcalinità.
Ora continuiamo con i calcoli per l’aggiunta del bicarbonato.
Ora prendiamo come esempio l’aggiunta di NaHCO3 per fornire carbonati e sodio in proporzioni adatte alla quantità di calcio aggiunta nel nostro esempio. Il CO3– o gruppo carbonatico ha una mole che pesa 60g (Carbonio=12g, 3xOssigeno=3×16=48 > TOT = 60)
L’idrogeno pesa 1g e il sodio 23g.
Quindi il totale del peso di una mole di NHCO3 = 60+23+1 = 84g.
La reazione è quindi la seguente:
CaCl2 + NaHCO3 < > Ca(HCO3)2 + NaCl
Ora cerchiamo di bilanciarla: a sinistra abbiamo 2 atomi di cloro e a destra 1 quindi
CaCl2 + NaHCO3 < > Ca(HCO3)2 + 2NaCl
Il 2 davanti una molecola o atomo moltiplica il numero di quell’atomo, nel nostro esempio un 2 davanti a NaCl significa che avrò 2 atomi di sodio e 2 atomi di Cloro.
Ora però a destra abbiamo 2 atomi di sodio e a sinistra ne abbiamo solo 1 (ovviamente in entrambi i casi essi sono legati ad altri atomi di cui dovremo fare il conteggio dopo l’aggiustamento). Quindi:
CaCl2 + 2NaHCO3 < > Ca(HCO3)2 + 2NaCl
Per gli altri atomi i numeri sono uguali a destra e sinistra. Ora la reazione è bilanciata.
Come si può vedere per ogni mole di CaCl2 dobbiamo aggiungere 2 moli di NaHCO3 e si formerà una mole di bicarbonato di calcio (solubile perché non è carbonato che invece non lo è) e 2 moli di NaCl, da tener conto per l’innalzamento della salinità.
Alla fine i coralli prenderanno il bicarbonato di calcio e espellendo lo ione H+ formeranno al loro interno il CaCO3 o carbonato di calcio insolubile che sarà il loro scheletro.
Nell’esempio noi avevamo bisogno di 36 g di calcio e siccome una mole pesa 40,1g noi ne avevamo bisogno un po’ meno di una mole pari a 36g diviso 40,1g=0,89mol. Questo numero rappresenta il fattore da moltiplicare per ottenere delle stime relative alla quantità di calcio che ci interessa e non rispetto all’unità che è 40,1g.
Poiché come abbiamo visto il NaHCO3 nella formula è doppio rispetto al cloruro di calcio dobbiamo moltiplicare 0,89 per 2 = 1,78 per avere un fattore di conversione attendibile rispetto alla nostra quantità. Abbiamo visto altresì che una mole di CO3– pesa circa 60g e che l’idrogeno pesa circa 1g. Il peso totale di una mole di HCO3- è quindi 61g. Ora io voglio sapere il peso di moli di HCO3- che devo usare in rapporto con la quantità di calcio che mi serviva e che è espressa dal fattore 1,78. Quindi moltiplico 1,78 x 61g che è il peso di HCO3- e ottengo 108,58 g che è il peso di idrogenocarbonato (bicarbonato) che si può appaiare chimicamente con 36 grammi di calcio. Ma io non posseggo o non compro solo bicarbonato ma tutta la molecola di bicarbonato di sodio NaHCO3 e quindi devo conteggiare il tutto per vedere quanto ne devo aggiungere, sapendo che per 36 grammi di calcio ho bisogno di 108,58 g di HCO3-.
Una mole di NaHCO3 pesa complessivamente 84 g, poiché 61g pesa HCO3- e circa 23g il Na.
84 g di NaHCO3 stanno a 61 g di HCO3- come X grammi di NaHCO3 stanno a 108,58 g di HCO3- ricalcolati.
X = (84 x 108,58) : 61
X = 147,88g (quantità di NaHCO3 che contiene la porzione giusta di HCO3- che reagirà con il CaCl2 per aggiungere 36 grammi di calcio).
Questo è tutto! Vedrete che in pratica è molto più semplice di quanto sembri. In fondo la Chimica ha così tanti avversari per il fatto che è una materia che spesso ha a che fare con il non visibile a occhio nudo e per questo risulta inaccessibile qualche volta.
L’ultimo mattone che ci manca è l’aggiunta del sale senza NaCl, in dosi proporzionate all’aggiunta di Calcio e Carbonati, per mantenere la porzione ionica del sistema stabile. Dobbiamo dire che dei cambi d’acqua, con cadenza settimanale e non oltre, potrebbero fare egregiamente il lavoro, senza l’aggiunta della soluzione deprivata della porzione di sale e quindi aggiungere solo CaCl2 e NaCO3 o NaHCO3. Ma a lungo andare questo può creare dei problemi. Quindi fate un ultimo sforzo e procediamo.
Abbiamo visto che nella reazione precedente ci vogliono 2 moli di NaCl per controbilanciare il cloruro di calcio e il carbonato di sodio. Una mole di NaCl pesa 58.5 g., perché il sodio pesa 23g/mole e il cloro 35.5 g/mole. QUindi siccome dobbiamo metter 2 moli di NaCl moltiplichiamo 58,5 x 2 = 117 g.
Hans Balling assume che la maggior parte dei sali sintetici in commercio abbia un contenuto di NaCl pari al 70%. Quindi per saper esattamente quanti grammi di sale senza NaCl dobbiamo aggiunger dobbiamo avvalerci di nuovo delle proporzioni e dei fattori di conversione prima usati e da quello che viene fuori se ne calcola il 30%, che sarà la porzione di sale da aggiungere senza la parte salina.
I calcoli ormai dovreste essere in grado di eseguirli da soli. Se avete bisogno di aiuto sapete dove trovarlo: da noi, e saremo lieti di assistervi.
Vi ricordo che questo metodo vale anche per il Magnesio che in un Reef sano ed equilibrato dovrebbe aggirarsi tra 1300 e 1400 mg/L. Il magnesio che si trova in giro di solo è in forma esaidrato, quindi contiene 6 moli di H2O da calcolare nei vostri conti.
Per ogni informazione sentitevi liberi di scriverci a carcla2003CHIOCCIOLAlibero.it.