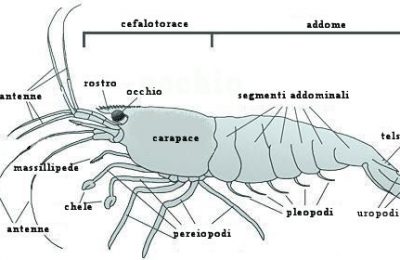
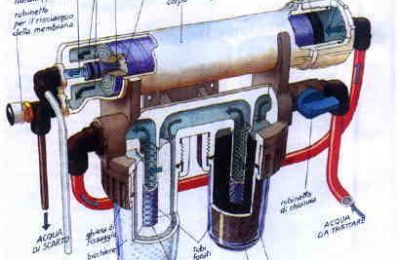
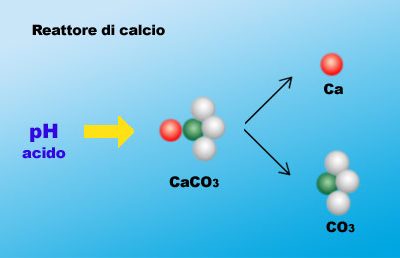
Questa nuova avventura di Atlantide, nel mondo sommerso delle profondità oceaniche, ci porterà nell’ importantissimo regno del Calcio e di tutta la sua interdipendente famiglia. Qualcuno potrebbe commentare che un altro articolo su questo importantissimo elemento è un esubero verbale o peggio ancora una tortura!! Vi invitiamo a leggerlo prima di qualsiasi giudizio qualitativo. In questo excursus chimico e funzionale tratteremo la chimica del calcio (in modo serio, poiché siamo fermamente convinti che l’ ignoranza è una droga che avvelena la nostra libertà di scelta e che si può e si deve sconfiggere) e solo dopo aver capito a fondo le interazioni semplici e complesse che si instaurano all’ interno di un bacino idrico di mare, come il nostro Acquario, passeremo ai metodi usati per la sua integrazione all’ interno delle nostre vasche, dando maggiore rilievo al metodo Balling, che, se usato in modo corretto, è l’ unica valida alternativa ad un reattore di calcio. PrologoLa chimica del calcio, assieme a quella strettamente connessa del magnesio, è di vitale importanza per un corretto allestimento, mantenimento e godimento di un acquario di barriera, oltre che per le fondamenta di un suo sviluppo armonioso e continuo nel tempo. Il successo di un acquario di barriera non è vederlo fiorire come un loto solo per pochissimo tempo, anche se la sua bellezza può rinfrancare lo spirito, ma è lo stabilirsi di un’ omeostasi biochimica bilanciata a tal punto da farlo durare negli anni a venire. Il Calcio è un elemento presente sul nostro pianeta in diversi composti e forme. La sua distribuzione e percentuale sono piuttosto cospicue, tanto da renderlo essenziale ai moltissimi processi biologici degli organismi più semplici e più complessi come quelli superiori. Non dimentichiamo che il calcio è il maggior costituente delle ossa umane e che la sua concentrazione nel nostro sangue è così importante per il movimento muscolare, che una sua deplezione può causare tetania muscolare (spasmi) o addirittura un arresto cardiaco. Per quanto riguarda gli invertebrati come granchi, gamberi e bivalvi per esempio, entra a far parte come elemento cardine dei gusci e degli esoscheletri. Gli oceani primordiali contenevano soprattutto magnesio e potassio, ancora oggi importantissimi cofattori dei meccanismi bio-fisico-chimici. Questo spiegherebbe perché ancor oggi il magnesio è in stretta connessione col calcio nell’ equilibrio delle acque oceaniche. Il Calcio assieme al magnesio è uno degli elementi più abbondanti delle acque marine. Infatti, assieme al cloro, sodio, potassio, solfati, carbonati e borati, è uno dei macroelementi costitutivi degli oceani. ChimicaIl calcio è stato scoperto in Inghilterra nel 1808 da Sir Humphry Davy. E’ un metallo alcalino terroso che appartiene al 2° gruppo della tavola periodica degli elementi chimici. Il suo stato di aggregazione è solido alla temperatura di 20 °C. La presenza nell’ ambiente acquatico è sotto forma di composti e di ione libero Ca2+. In natura gli atomi degli elementi costitutivi della materia si trovano spesso sotto forma di ioni positivi o negativi. Gli atomi sono costituiti da un nucleo formato da protoni, carichi positivamente, e neutroni, che non posseggono carica e da 1 o più orbitali in cui si muovono gli elettroni, che sono carichi negativamente. Gli orbitali sono “scie” elettroniche di forma circolare o ellittica in cui si trovano gli elettroni, che come in un sistema planetario ruotano nei loro orbitali attorno al nucleo, da cui, a causa della diversa polarità elettrochimica (positiva), sono attratti. Diciamo che per un parallelismo grossolano la forza di attrazione elettrochimica tra gli elettroni (-) e il nucleo (+) di un atomo è comparabile a quella gravitazionale tra un pianeta e i suoi satelliti. Gli elementi chimici possono avere minimo un orbitale (come l’ idrogeno che possiede solo un elettrone e un solo protone) o più orbitali. Ogni orbitale può al massimo ospitare 2 elettroni. Il numero atomico di un atomo è dato dal numero delle cariche positive, cioè i protoni. Quindi nel caso dell’ idrogeno che possiede un solo protone il numero atomico è 1. Normalmente il numero dei neutroni (cariche neutre) è uguale al numero dei protoni e la somma dei neutroni e dei protoni determinano la massa atomica, anche se il peso totale dell’ atomo è dato dal confronto del carbonio 12. Esistono degli atomi che hanno un esubero di neutroni, cioè questi non eguagliano più il numero dei protoni. Tali atomi sono chiamati isotopi e la loro chimica rientra nella specialità della chimica radioattiva. Per questo prima abbiamo enunciato il carbonio 12, per distinguerlo dal carbonio 14 che è un isotopo radioattivo con un esubero di cariche di neutroni. Alcuni atomi non si trovano come singoli elementi, ma in forma di molecole bi o pluri-atomiche (O2-ossigeno, Cl2-cloro, S8-zolfo, P4-fosforo). Il cloro, per esempio, quando non reagisce con altri atomi per formare composti, si trova sotto forma di composto biatomico Cl2, in cui i legami che si instaurano tra i 2 atomi non spostano in nessun modo l’ equilibrio elettrico della molecola. Ciò vuol dire che gli elettroni spesi per formare un legame tra 2 atomi di cloro non vengono “rapiti” verso un atomo piuttosto che un altro, ma rimangono stabilmente ed equamente messi a disposizione di entrambi e pertanto la distribuzione della carica è equamente distribuita su entrambi gli atomi. Da tutto ciò appare evidente che in chimica la natura dei legami fra atomi per la formazione di composti avviene per opera della porzione elettronica degli orbitali, piuttosto che di quella del nucleo. Sappiamo che gli ioni sono degli atomi che possono perdere o acquistare elettroni in base alla loro energia di ionizzazione. Tale peculiare capacità trasforma gli atomi in ioni positivi (perdita di elettroni dagli orbitali più esterni) o ioni negativi (acquisizione di elettroni negli orbitali più esterni). Possiamo affermare che l’ energia di ionizzazione (cioè la tendenza a trasformarsi in ioni) è determinata soprattutto dal nucleo atomico e dal raggio atomico. Maggiore è il raggio e quindi la distanza tra nucleo e orbitale più esterno e meno diventa il potere attrattivo del nucleo su quegli elettroni, causando nell’ atomo una tendenza a perdere elettroni. Questo aspetto ne determina il comportamento anche durante la formazione dei legami per generare composti. La natura dei legami che si formano tra gli atomi è guidata anche dalla valenza di ogni singolo atomo costituente il composto. Ma che cos’ è la valenza e in che modo influenza un legame chimico? Secondo la teoria dell’ ottetto di Lewis (che non spiega però la complessità di altri legami come quelli della chimica del carbonio, ma che per ragione di semplicità e pertinenza citiamo come unica) il numero degli elettroni che gli atomi tendono ad avere attorno per raggiungere un equilibrio devono essere 8. O meglio: gli atomi tendono a saturare tutti gli orbitali esterni al nucleo fino a raggiungere il numero perfetto di 8. Ma perché il numero 8 e perché si dice perfetto? Nella tavola degli elementi l’ ultimo gruppo a destra della tavola elenca degli elementi chiamati gas nobili ( Elio, Neon, Argo, Xeno ecc.) che sono definiti perfetti perché sono talmente stabili da non avere potere di reazione (in teoria), cioè tendono a non reagire con altri elementi per formare composti. Quindi se ne deduce che tutti gli altri atomi tendono verso una situazione energetica stabile che li porta a reagire per formare composti in cui possono trovare quella “pace” di cui tanto abbisognano, cioè l’ equilibrio chimico dei gas nobili. Eccezione alla regola dell’ ottetto di Lewis è l’ atomo di idrogeno che può possedere solo 2 elettroni nell’ unico orbitale che possiede per raggiungere la perfezione. Questo perché ogni orbitale può ospitare al massimo 2 elettroni e siccome l’ idrogeno possiede un singolo orbitale allora per saturarlo completamente e raggiungere la stabilità può arrivare al numero perfetto 2. Per gli altri atomi che possiedono più orbitali vale la regola dell’ ottetto. La valenza di un atomo, semplicisticamente, è il numero di elettroni necessari a completare l’ ottetto di un atomo coinvolto in un composto. Così nel caso dell’ acqua la valenza dell’ ossigeno è 2 poiché esso abbisogna di 2 elettroni per completare l’ ottetto di elettroni nei suoi orbitali per raggiungere lo stato di perfezione chimica. Siccome l’ idrogeno possiede un elettrone , 2 atomi di idrogeno possono fornire all’ ossigeno il numero necessario. A sua volta l’ idrogeno che a differenza di tutti gli altri per raggiungere lo stato di perfezione abbisogna di 2 elettroni nel suo unico orbitale, possedendo un solo elettrone, ha bisogno di un altro elettrone (quindi ha valenza 1) per completare il duetto. Quindi i due elettroni dell’ idrogeno durante la formazione del composto dell’ acqua soddisferanno i bisogni dell’ ossigeno che a sua volta soddisferà i bisogni dell’ idrogeno, formando un composto stabile e fantastico. L’ acqua, però, è un composto assai particolare, poiché a causa della natura dell’ ossigeno (che è fortemente elettronegativo, cioè tende a strappare gli elettroni all’ idrogeno) e alla natura dell’ idrogeno che tende a formare legami deboli, tale molecola si trova a possedere una natura bipolare, avendo una polarità negativa (ossigeno) e una positiva (idrogeno), che le conferisce delle eccezionali proprietà chimico-fisiche. Es.: Il cloro ha 7 elettroni nell’ ultimo orbitale e quindi ha bisogno di 1 solo elettrone (valenza 1 quindi) per completare l’ ottetto, il quale verrà fornito da ognuno degli atomi di cloro, mettendoli a disposizione a turno. Questo tipo di legame di solito si indica con una linea che sta a indicare quanti elettroni entrano a far parte del legame: Nel caso dell’ elemento azoto, che si trova in forma biatomica anch’ esso (N2), la valenza è pari a 3, cioè esso ha sull’ orbitale più esterno 5 elettroni e necessita di altri 3 elettroni per completare l’ ottetto, che in questo caso saranno forniti a turno da entrambi gli atomi di azoto che in tal modo soddisferanno il loro bisogno energetico. Siccome il numero di elettroni messi in gioco in questo legame è 3, tale legame si indica con due simboli “N” uniti da tre linee questa volta. Idrogeno (H) + Cloro (Cl) reagiscono per formare acido cloridrico (HCl) dove il legame è svolto tramite 1 elettrone solo messo in comune fra loro poiché entrambi hanno valenza 1. Nell’ anidride solforica (SO3) lo zolfo ha solo 2 elettroni nell’ ultimo orbitale e quindi ha valenza 6 e l’ ossigeno ha valenza 2. Quindi ci vogliono 3 atomi di ossigeno per completare i rispettivi ottetti. Quindi un atomo di ossigeno prenderà 2 elettroni dallo zolfo per soddisfare l’ ottetto, e tutti e 6 gli elettroni dei 3 atomi di ossigeno soddisferanno a loro volta la valenza dello zolfo. Tornando al calcio, il simbolo “2+” vicino al calcio indica che il suo stato atomico è in forma di ione positivo, cioè l’ elemento calcio in natura si trova spesso sprovvisto di 2 elettroni, che gli conferiscono un esubero di cariche positive del nucleo. Non confondete il numero positivo o negativo in alto con il numero senza segno in basso di un atomo. Il primo indica lo stato di ione e quanti elettroni ha perso o guadagnato (Ca2+, Na+, Cl-), mentre il numero in basso senza segno indica il numero di atomi presenti in una molecola ( H2O, CO2). Ma che significa che un atomo si trova “naturalmente” in forma ionizzata? Spesso questo è un argomento ingoiato, ma mal digerito. Facciamo un esempio per aiutarci: il cloruro di sodio la cui formula è NaCl e che è il maggior componente della salinità marina. Sembra che la presenza di questo cloruro sia derivata dalle polveri vulcaniche che milioni di anni fa hanno saturato l’ atmosfera terrestre e che con le conseguenti piogge avrebbe arricchito l’ acqua degli oceani. Il cloruro di sodio è di solito presente in forma di aggregati cristallini che conosciamo molto bene visto che è il nostro sale da cucina. Quindi è in forma solida e il composto NaCl è in equilibrio chimico. Il cloro (Cl) come abbiamo visto prima ha 7 elettroni nell’ orbitale più esterno e ha bisogno solo di 1 elettrone per completare l’ ottetto e per tale motivo tende a comportarsi come accettore di elettroni, mentre il sodio (Na) possedendo solo 1 elettrone nell’ ultimo orbitale e per completare l’ ottetto abbisogna di ben 7 elettroni tenderà a comportarsi come donatore dell’ elettrone solitario. Il composto NaCl soddisferà tali aspettative. Ma non appena questi cristalli entrano in soluzione in acqua l’ equilibrio dei legami chimici che tengono uniti il sodio e il cloro viene disturbato dalle molecole bipolari dell’ acqua che portano “in soluzione” la perdita o l’ acquisizione di un elettrone con la conseguente formazione di Na+(positivo per perdita di un elettrone) e Cl-(negativo per aver “rapito” un elettrone sul suo orbitale esterno). Se andiamo a vedere le caratteristiche dell’ energia di ionizzazione e del raggio atomico di questi due elementi, vedremo come questo comportamento fosse prevedibile. Comunque l’ importante è capire che gli atomi ionizzati si formano in fluidi come l’ acqua, non dimenticando che anche l’ aria è un fluido e possiamo avere anche qui reazioni e formazioni di ioni, ovviamente per elementi gassosi. Tutto chiaro? Bene procediamo! Torniamo al calcio: esso di solito ha numero di ossidazione +2. Ricordiamo che il potere di ossidazione è la proprietà di un atomo che tende, durante la formazione di legami con altri atomi, ad avere un maggior potere di controllo sugli elettroni dell’ altro elemento o ad averne meno. Quindi poiché il calcio ha numero di ossidazione positivo uguale a 2, significa che durante le interazioni atomiche con gli altri elementi per formare composti cederà il controllo di 2 elettroni all’ elemento con cui entrerà in contatto. Per questo esso viene definito riducente (cioè dona elettroni o ha meno potere di controllo su di essi), a differenza degli ossidanti che tendono ad avere più controllo sugli elettroni dell’ elemento con cui formano un composto e il cui numero di ossidazione avrà segno meno. Il comportamento ossido-riduttivo si instaura durante la formazione di legami fra specie chimiche e in generale possiamo affermare che gran parte delle reazioni chimiche sono ossido-riduzioni. Siccome in chimica non possono esistere elettroni liberi, un elemento si riduce soltanto se esiste nella reazione un altro che si ossida. Per capire appieno il concetto di ossido-riduzione dobbiamo unire i concetti già visti di valenza e elettronegatività. Abbiamo visto che cos’ è la valenza e che un atomo è tanto più elettronegativo se il suo nucleo ha molta energia per strappare elettroni ad altri atomi che quindi saranno meno elettronegativi. L’ atomo più elettronegativo di tutti è il fluoro (F) seguito subito dopo dall’ ossigeno (O). Per capire quindi l’ ossidoriduzione dobbiamo dire che il numero di ossidoriduzione è il numero di elettroni che un atomo perde o acquista in un legame in base alla sua elettronegatività e di quella degli altri atomi con cui forma un legame. Ma un legame è determinato anche dalla valenza degli elementi che lo compongono, ed ecco quindi che valenza ed elettronegatività sono gli elementi costitutivi del numero di ossido riduzione. Prima di vedere a cosa diavolo serve tutto questo facciamo un piccolo punto della situazione: * Gli elementi neutri ( cioè non ionizzati come Hg, Li, Fe ecc.) ed elementi poliatomici neutri (O2, PO4, Cl2, ecc.) hanno numero di ossidazione zero, poiché essi non entrano ancora a far parte di nessun legame con altri elementi diversi e non si trovano in stato di ioni. * Nel caso degli ioni il numero di ossidazione è uguale per numero e per segno alla carica dello ione. Es.: Cu++=+2; Cl- = -1. * L’ idrogeno ha sempre numero di ossidazione +1, tranne nel caso degli idruri (MgH2 magnesio diidruro) in cui ha numero di ossidazione pari a -1 a causa del fatto che in questi composti gli altri elementi sono meno elettronegativi dell’ idrogeno. Infatti il magnesio (come il calcio) ha numero di ossidazione +2 mostrando una bassa elettronegatività, cioè rispetto all’ idrogeno tendono a donare elettroni e a trasformarsi in ioni positivi. * L’ ossigeno ha sempre num. ossidazione pari a -2 tranne che nei perossidi (H2O2, acqua ossigenata) in cui ha il numero di ossidazione è pari a -1 e quando è legato al fluoro che è l’ unico elemento più elettronegativo di lui e in cui il num. d’ ossidazione dell’ ossigeno diventa +2. * Nei composti il numero di ossidazione è pari a zero per i composti neutri e pari alla carica per i composti ionici (HCO3- = -1, CO3– = -2, ECC.). Per la legge di Lavoisier la “quantità di materia” si conserva, quindi la quantità degli elementi che reagiscono a sinistra di una reazione chimica deve essere uguale a quella che avremo a destra. Questa operazione si chiama bilanciamento stechiometrico. Vediamo ora come queste nozioni entrino a far parte delle reazioni di ossidoriduzione e di come quasi tutte le reazioni chimiche ne siano influenzate. Facciamo finta di essere dei chimici e prepariamo una soluzione acquosa (H2O) di cloro gassoso (Cl2, ricordatevi che un gas può entrare in soluzione, sennò come farebbe lo champagne ad avere le bollicine) e acido iodidrico (HI) con formazione di acido cloridrico (HCl) ed acido iodico (HIO3) secondo la seguente reazione Cl2 + HI +H2O >> HCl + HIO3 Questa reazione ci dice che cosa si formerà facendo reagire i vari composti ma non ci dice in che rapporti le sostanze reagiranno tra loro. In poche parole non ci dà alcun riferimento sulla quantità degli elementi che andranno a reagire. Infatti per la legge di Lavoisier non abbiamo lo stesso numero di atomi a destra e a sinistra, poiché se prendiamo per esempio l’ ossigeno (O) a sinistra ne troviamo solo 1, mentre a destra ne troviamo 3. Attraverso i processi di ossidoriduzione che avverranno in questa reazione saremo in grado di aggiustarla. Abbiamo detto che gli elementi singoli o poliatomici come il Cl2 hanno numero di ossidazione 0. Durante la reazione con l’ idrogeno per formare HCl il cloro essendo più elettronegativo dell’ idrogeno tenderà ad essere un accettore (ossidante) e ruberà l’ unico elettrone all’ idrogeno che sarà un donatore (riducente). Quindi il cloro passerà da numero di ossidazione 0 a numero -1 per avere un maggior potere sull’ elettrone dell’ idrogeno. Quindi il bilanciamento ha a che fare con le quantità degli atomi che entrano a far parte di una reazione e tali quantità sono strettamente legate alle reazione redox che operano uno spostamento di elettroni e quindi energetico. Tutta la chimica atomica dell’ universo è regolata da queste leggi, tanto nello spazio siderale, quanto nelle profondità degli abissi oceanici. 1) Tutta la materia è formata da atomi che possono trovarsi nella forma neutra (non carica) e ionica (carica positivamente o negativamente). 2) Le caratteristiche di un atomo o elemento sono determinate dalla struttura subatomica del nucleo e degli orbitali che contengono gli elettroni. 3) Gli elementi si aggregano fra loro per formare composti poli-atomici che possono essere anche loro elettricamente neutri o in forma ionica (HCO3-). 4) I composti sono quindi formati da elementi (atomi) che si legano fra loro con speciali legami determinati dalla struttura degli orbitali e dal numero degli elettroni ospitati in essi (concetto di valenza). 5) Il potere ossidante o riducente di un elemento è determinato dal potere elettronegativo del nucleo dell’ atomo in questione. Se un nucleo di un atomo ha propensione a strappare elettroni all’ altro atomo con cui sta formando un legame, tenderà ad attirare elettroni verso di sé (ossidante) mentre l’ altro tenderà a cederli (riducente). 6) Il calcio è un metallo, presente di solito in forma ionica positiva (Ca2+) con numero di ossidazione +2, cioè durante i legami con atomi fortemente elettronegativi (come l’ ossigeno) tende a donare 2 elettroni, o meglio a perdere il controllo su di essi, i quali tenderanno a ruotare in prossimità dell’ altro atomo. Esso pertanto verrà considerato riducente, mentre l’ altro atomo con alto potere attrattivo verrà chiamato ossidante. Esempi di composti con calcio: Ca(OH)2 >> Idrossido di calcio >> Il calcio ha valenza 2 e il gruppo ossidrilico ha valenza 1 perché la necessità dell’ Ossigeno di avere 2 atomi viene soddisfatta in parte da 1 atomo di idrogeno che può donare solo 1 elettrone. Il gruppo ossidrilico quando non fa parte di composti si presenta in forma ionica negativa (OH-) poiché l’ ossigeno tende a strappare anche l’ altro elettrone del secondo atomo dell’ idrogeno in questa reazione di dissociazione: H2O >> H+ + OH- CaCl2 >> Cloruro di calcio >> Il cloro ha valenza 1. MgCl2 >> Cloruro di magnesio >> Il Magnesio anch’ esso si trova in forma ionica Mg2+ e ha la stessa valenza del calcio. CO2 >> Biossido di carbonio >> Carbonio ha valenza 4 e ossigeno valenza 2. Il carbonio e alcuni altri elementi hanno più di una valenza ( nella CO per esempio chiamata monossido di carbonio) per fenomeni atomici più o meno complessi che non servono a questa spiegazione per fortuna. Infatti la chimica del carbonio è una storia a sé. CaCO3 >> Carbonato di calcio >> Il gruppo CO3- – è considerato un gruppo con valenza 2. Il doppio segno meno deriva dalla reazione di dissociazione: NaHCO3 >> Bicarbonato (Idrogeno carbonato) di sodio >> Il sodio (Na) e il gruppo hanno entrambi valenza 1. Na2CO3 >> Carbonato di sodio (soda) Il calcio negli oceaniLa concentrazione del calcio come elemento libero (cioè non coinvolto in composti) nel mare è determinata soprattutto dalla sua forma di ione positivo (Ca2+) e corrisponde a circa 400mg/L. La sua concentrazione attorno alle barriere coralline di solito è un po’ più consistente e può raggiungere anche i 450mg/L. La misurazione mg/L. è una fra le tante misurazioni possibili in chimica che vedremo più tardi. In questo caso sono presenti 450 milligrammi (un milligrammo è la millesima parte di un grammo e la milionesima parte di un chilo). Ma da dove viene il calcio necessario alla vita degli oceani??? L’ anidride carbonica presente nell’ atmosfera è in parte solubile nell’ acqua piovana con cui forma una soluzione acida, grazie alla formazione di un acido debole come l’ acido carbonico (il fenomeno ambientale delle piogge acide è un problema legato all’ inquinamento che causa una massiccia presenza di CO2 nell’ atmosfera). Tale acido, cadendo assieme alla pioggia, provoca un’ alterazione chimica dei minerali contenuti all’ interno delle rocce carbonatiche (presenza di carbonati) e silicatiche (presenza di silicati) e altri tipi. Le principali rocce carbonatiche sono rocce sedimentarie, cioè formatesi nei milioni di anni di evoluzione geologica per sedimentazione di materiali o per fissazione di gusci di organismi morti e sepolti nelle profondità oceaniche, portati poi in superficie dai vulcani o da altri fenomeni geologici. Le principali rocce carbonatiche sono: * Calcite: principale costituente delle rocce calcaree, del guscio dei bivalvi, formata da carbonato e calcio >> CaCO3 * Magnesite: magnesio e carbonato >> MgCO3 * Dolomite: magnesio e calcio assieme al carbonato >> CaMg(CO3)2 * Siderite: ferro e carbonati >> FeCO3 * Aragonite: sabbia, in parte lo scheletro dei coralli * Malachite, ecc. La calcite è il tipico minerale sedimentario carbonatico e si forma per precipitazione chimica da soluzioni cariche di bicarbonato di calcio e forma stalattiti, stalagmiti, travertini, ecc. Una volta che le alterazione per opera dell’ acido carbonico, formatosi nell’ acqua piovana, sulle rocce carbonatiche ha avuto luogo, vengono liberati da queste rocce ioni calcio, ioni bicarbonato (oltre ad altri minerali come magnesio, silice ecc. a seconda del tipo di roccia interessata dall’ erosione) che passano in soluzione. Questi soluti sono trasportati dai fiumi agli oceani, dove gli organismi viventi li incorporano per formare scheletri e gusci formando nuovamente carbonato di calcio. Alla morte degli organismi viventi che hanno incorporato carbonato di calcio, avviene la deposizione dei carbonati sui fondali assieme a fenomeni di precipitazione carbonatica direttamente dall’ acqua marina stessa. I fondali e i sedimenti carbonatici sono inglobati all’ interno del manto terrestre per il naturale movimento tettonico della crosta terrestre oceanica e, a causa delle alte temperature sotto la crosta e le alte pressioni, tali sedimenti entrano a far parte del magma fondendosi e attraverso l’ azione di eruzione vulcaniche liberano nuovi minerali per nuove rocce e anidride carbonica che torna di nuovo nell’ atmosfera. In natura la maggior parte del calcio in acqua marina è in forma libera ionica e meno del 20% è legato soprattutto ai solfati e carbonati. I carbonati invece sono per più dell’ 80% legati per formare composti e meno del 20% si presentano come ioni liberi ed entrano in gioco nei processi descritti. Di solito la maggior parte dei carbonati presente in acqua marina è legata sotto forma di bicarbonato (HCO3-) con magnesio innanzitutto e pochissimo con calcio, formando dei composti solubili in acqua. Poiché i (bi)carbonati che possono rimanere in soluzione sono soltanto all’ incirca il 20%, un aumento di questa concentrazione provocherebbe una supersaturazione di (bi)carbonati che tenderebbero a precipitare. Quindi questo dimostrerebbe in parte l’ importanza di una concentrazione ottimale di minerali (soprattutto magnesio, poiché è quello più legato ad essi e non li lascerebbe liberi provocando fenomeni di saturazione). In più se la salinità è bassa ci sarà ancora più difficoltà a mantenere una concentrazione elevata di (bi)carbonati, poiché come abbiamo detto questi si trovano per l’ 80% legati in composti solubili in acqua ed essendoci pochi minerali (soprattutto magnesio) con cui legarsi essi si trasformerebbero in CO3- – e formerebbero dei composti insolubili (con calcio soprattutto, ma anche magnesio e stronzio) che precipitano. Quindi ai fini di un giusto meccanismo del calcio e della durezza carbonatica bisogno tenere d’ occhio il magnesio e la salinità che ricordiamo in mare è di 35 ppt (parti per mille), che corrisponderebbe, ad una temperatura di 20°C, ad una densità di 1026/1027 (ricordatevi che la densità diminuisce se viene misurata a temperature più alte di 20°C. Quindi ad una temperatura tipica di 25/26°C la densità risulterebbe di 1025). Nel nostro AcquarioNelle nostre amate vasche di barriera questo ciclo è incompleto e viene simulato. Vediamo come. A pressione atmosferica l’ anidride carbonica è moderatamente solubile nell’ acqua. La CO2 deriva direttamente dall’ aria a stretto contatto con il pelo dell’ acqua, attraverso cui la CO2 entra e esce continuamente dal nostro acquario a causa dei meccanismi che stiamo per vedere. Essa si forma dalla respirazione cellulare degli animali oppure anche attraverso un impianto di CO2 per reattori di calcio (il cui funzionamento è stato copiato proprio dai processi in discussione in questo articolo). La CO2 forma con l’ acqua, come abbiamo visto in precedenza durante il ciclo geochimico, un acido debole chiamato acido carbonico secondo la seguente reazione: A questo punto l’ acido carbonico in acqua si dissocia in ioni: H2CO3 + H2O <-> H3O+ + HCO3- L’ H3O+ (H2O assieme a H+) sono ioni idrogeno in soluzione che rendono il pH acido e l’ HCO3- è lo ione bicarbonato che può subire eventualmente una ulteriore trasformazione: HCO3- + H2O <-> H3O+ + CO3– con formazione finale di ione carbonato (CO3–). Tenete d’ occhio quest’ ultima reazione poiché è importantissima nelle situazioni estreme di precipitazione. Tutte queste reazioni avvengono continuamente in acquario e tendono a mantenersi in equilibrio, espellendo o invitando più o meno CO2. A meno che succeda qualcosa dall’ esterno. Come abbiamo detto prima, la conseguente formazione di bicarbonato e ioni idrogeno reagiscono con i minerali carbonatici delle rocce ( nel nostro caso con il substrato all’ interno del reattore di calcio, poiché è l’ unico ambiente abbastanza acido da provocare una tale deformazione): HCO3- + CaCO3 (carbonato di calcio) + H3O+ <-> Ca++ + 2HCO3- +H2O La presenza degli ioni idrogeno (H3O+) è responsabile della caduta del pH, formando un ambiente acido. In vasca e non in un reattore le leggere fluttazioni del pH verso l’ acidità vengono tamponate dagli ioni bicarbonato che secondo le reazioni di prima formerebbero acido carbonico e espellerebbero l’ eccesso di CO2. Infatti il pH è strettamente legato alla concentrazione di ioni idrogeno: maggiore è tale concentrazione, più acido sarà il pH e viceversa. Gli ioni idrogeno in soluzione vengono ceduti da composti chiamati acidi (come l’ acido carbonico) che, rilasciando una quantità di ioni idrogeno, influenzerà il pH facendolo abbassare sotto il punto di neutralità che è 7. Quindi se il valore di pH è sotto il 7 la soluzione è acida, al di sopra del 7 viene definita basica (una base, al contrario, è un composto che è in grado di innalzare il pH). Per essere giusti dobbiamo dire che il pH è l’ espressione della concentrazione degli ioni idrogeno in soluzione. Riprenderemo questo discorso più dettagliatamente in seguito. L’ ultima reazione chimica che abbiamo descritto prende il nome di dissoluzione dei carbonati che porta a formazione come abbiamo visto di calcio e bicarbonato, che attraverso i fiumi arrivano fino agli oceani e che nel nostro caso entrano direttamente nell’ acquario dall’ efflusso del reattore di calcio. Ma poiché il calcio e i carbonati vengono continuamente portati dai fiumi ai mari, la concentrazione di questi composti raggiunge una supersaturazione provocando il fenomeno di precipitazione dei carbonati. Che vuol dire supersaturazione? Una sostanza (soluto) disciolta in acqua (solvente) viene chiamata soluzione. Se noi aumentiamo la concentrazione di soluto arriviamo ad un punto chiamato saturazione oltre il quale il solvente (l’ acqua in questo caso) non riesce a mantenere più in soluzione le molecole di soluto che precipiteranno verso il fondo. Il tasso di precipitazione negli oceani è uguale al tasso di immissione e per tale motivo la concentrazione rimane costante nel tempo. 2HCO3- + Ca++ <-> CaCO3 + H2O +CO2 Questa reazione come si vede è dipendente dalla concentrazione degli ioni calcio e bicarbonato il cui aumento oltre la soglia di saturazione provoca precipitazione con formazione di calcite (carbonato di calcio) che è insolubile a pH alcalini (superiori a 7) come il pH dei nostri Reef, e tutto ciò porta ad una diminuzione di Calcio e altri minerali (Magnesio, stronzio ecc.) che essendo precipitati non sono più disponibili a valori di pH presenti nelle nostre vasche. Vedremo fra poco perché gli altri minerali e soprattutto il magnesio crollano assieme al calcio nei fenomeni di precipitazione o sedimentazione. Ma che fine fa nei nostri acquari il carbonato di calcio precipitato? Forma degli ammassi biancastri e duri su tutti i substrati del nostro acquario (rocce, sabbia, ecc.) e che non sono più disponibili per un’ assimilazione da parte degli organismi viventi. L’ aumento della CO2 aumenta invece la dissoluzione dei carbonati. Tutto ciò è dipendente anche dalla salinità, dalla pressione e temperatura. Nei mari freddi la dissoluzione è maggiore, mentre nei mari caldi è maggiore la sedimentazione o precipitazione. Tutto ciò è governato dal principio di Le Chatelier che asserisce che se in una reazione chimica viene aumentata la concentrazione di un elemento a sinistra della reazione, la reazione stessa procederà verso destra fino ad un nuovo equilibrio. Naturalmente vale anche il contrario. Quindi se noi innalziamo i bicarbonati (aumentando il KH che è la misurazione della presenza di carbonati e bicarbonato soprattutto, come vedremo in seguito) e/o il calcio la reazione procederà verso destra superando la soglia di un equilibrio chimico delle soluzioni con conseguente precipitazione e viceversa. Ecco perché spesso si dice che la durezza carbonatica e la concentrazione di calcio sono intimamente legati e devono essere compresi per la giusta somministrazione senza eventuali precipitazioni. Appare del tutto chiaro che anche nei nostri acquari i fenomeni di dissoluzione possono avvenire soltanto o per forti cadute accidentali (e catastrofiche per la vita degli ospiti) del pH con alterazioni della struttura minerale dei carbonati delle rocce e dell’ aragonite contenuta nella sabbia, o per installazioni di reattori ad hoc. La lenta dissoluzione dell’ aragonite (che dissolve a pH meno acidi della calcite) e dei materiali carbonatici per modesti spostamenti di pH o per piccole nicchie più acide interne al nostro acquario, hanno una modestissima entità da non apportare un significativo aumento del calcio in una vasca di barriera. D’ altra parte i fenomeni di precipitazione in acquario sono ben più frequenti (anche per processi naturali) e a volte ingenti (innaturali), provocando una continua deplezione del Calcio e di altri minerali quali Magnesio e Stronzio. Oltre a ciò esiste anche una precipitazione biotica (ad opera di organismi viventi) del calcio e dei carbonati come avviene nei coralli, che provoca un naturale abbassamento di calcio e carbonati. Resta quindi essenziale reintegrare continuamente questi minerali ed evitare il più possibile fenomeni di ingenti precipitazioni. Ma di tutto questo ne parleremo fra poco. AlcalinitàPrima di procedere per affondare ancora di più le nostre radici in questo argomento, facciamo una premessa. Abbiamo visto in precedenza che immettendo CO2 nel nostro sistema questo porta a formazione di acido carbonico che dissociandosi provoca un aumento di H+ che a sua volta abbassa il pH. L’ abbassamento del pH provoca una reazione del sistema chimico che tampona la concentrazione di H+ con i carbonati presenti in soluzione nell’ acqua (KH). Ma per il principio di Le Chatelier se la concentrazione di bicarbonato aumenta sposterà la reazione vista in precedenza che procederà verso la formazione di acido carbonico, il quale a sua volta si dissocerà ancora in CO2 e H2O. H2CO3 <-> H2O + CO2 La CO2 attraverso la superficie dell’ acqua per scambio gassoso uscirà fuori dall’ acqua nell’ ambiente circostante. Quindi questo esemplifica che sebbene siano avvenute molte reazioni chimiche l’ equilibrio totale del sistema non cambia. Ma se invece l’ aumento della concentrazione del bicarbonato è veloce e repentina, il sistema si troverebbe a gestire un aumento tale da provocare supersaturazione e conseguente precipitazione, ma questa volta l’ equilibrio sarà cambiato per perdita della concentrazione di carbonati, bicarbonato e altri minerali per precipitazione in composti insolubili e quindi inutilizzabili dal sistema a meno che si abbassi il pH a livelli molto acidi che sono incompatibili con la vita degli organismi marini. Infatti quando abbiamo bisogno di un ambiente così acido da permettere la dissoluzione dei carbonati e calcio utilizziamo un sistema chiuso, come il reattore di calcio, in cui possiamo far avvenire delle reazioni chimiche in ambienti speciali. Ma che impatto ha tutto questo sull’ alcalinità e cos’ è l’ alcalinità? L’ alcalinità è la somma della concentrazione molare (una misurazione chimica che vedremo in seguito) dei seguenti composti: Alcalinità TOT. = [CO3, CONCENTRAZIONE CARBONATI]+[HCO3, CONCENTRAZIONE BICARBONATI]+[OH, CONCENTRAZIONE GRUPPI OSSIDRILICI]+[B(OH)4, CONCENTRAZIONE BORATI]+[HPO4/PO4, FOSFATI]+ ALTRI. Ma poiché le concentrazioni veramente rilevanti sono solo quelle dei carbonati e borati (gli altri sono presenti in concentrazioni molto piccole) possiamo assumere, con una percentuale di errore trascurabile, che l’ alcalinità totale è la somma delle concentrazioni molari di [HCO3]+[CO3]+[B(OH)4] (Alcalinità totale aggiustata) Invece la durezza carbonatica (KH) rappresenta ancora una percentuale più bassa dell’ alcalinità e rappresenta la somma delle concentrazioni dei carbonati e bicarbonati soltanto. Quindi se misuriamo con un test per il KH un campione di acqua vediamo che la maggior parte dei test misura l’ alcalinità e non solo la durezza carbonatica. Infatti se mettiamo nella provetta di misurazione dell’ acqua distillata che non possiede alcun carbonato e aggiungiamo un composto che contenga soltanto gruppi ossidrilici (OH-) e poi testiamo il campione, vedremo che il risultato darà esito positivo. Perché??? Come abbiamo visto in precedenza l’ alcalinità totale risulta dalla sommatoria di molte sostanze fra cui il gruppo ossidrilico (OH) che influenza il test positivamente anche se nel nostro campione non è presente nemmeno un’ oncia di carbonati. Quindi questo indica che il nostro test per il KH è in verità un test di misurazione di alcalinità. Quindi siccome la presenza dei gruppi ossidrilici e degli altri è presente in misure piccolissime, tranne che per i carbonati, l’ alcalinità e il KH nel nostro caso acquaristico è intercambiabile anche se concettualmente non lo è. Per passare dall’ alcalinità alla durezza carbonatica usate la seguente formula: Alcalinità in mE/L = KH/2.8 mE/L. significa millequivalenti a litro e vedremo in seguito cos’ è e come rappresenti un altro metodo di misurazione chimica. Se aumento la salinità possono precipitare il calcio e la durezza carbonatica. VERO E FALSO Se da un lato la salinità aumentata farà aumentare la concentrazione molare dei carbonati in soluzione e del calcio esponendo ad un eventuale rischio di precipitazione, è anche vero che la maggior presenza di magnesio e altri minerali che sono legati ai carbonati rendono questi meno liberi in soluzione e per tale motivo, rendono meno soggetto il sistema ad eventuali precipitazioni. Quindi per un sistema più stabile mantenete la salinità a livelli “naturali” e non soggettivi o per risparmiare sale. I soldi si risparmiano in altro modo, con intelligenza e conoscenza e non a danno degli esseri viventi, poiché una massiccia precipitazione di carbonati e calcio nel vostro acquario può essere disastrosa per tutti, mettendo a rischio la vita dei suoi abitanti. Se aggiungo kalkwasser posso far precipitare il calcio. VERO e FALSO La kalkwasser [Ca(OH)2] è un composto che in soluzione ha pH=12,4 ed è un ottimo ausilio per l’ integrazione di calcio (per vasche con basso bisogno di calcio) e soprattutto di alcalinità per il rifornimento di ioni ossidrilici secondo la reazione Ca(OH)2 >> Ca2+ + 2OH-. Poiché l’ aumento di ioni ossidrilici tampona la concentrazione di H+, il pH tende ad aumentare. In questo modo forniamo alcalinità e calcio al sistema. Ma perché il metodo di somministrazione di kalkwasser deve essere molto lento, facendo attenzione che sia inserita solo goccia a goccia? Se immetto nel sistema troppa kalkwasser e troppo rapidamente l’ aumento repentino di OH- provocherà un aumento drastico e improvviso del pH che oltre ad avere effetti deleteri sugli organismi viventi che sono abituati a pH stabili, rende la concentrazione di bicarbonato (HCO3-) aumentata, poiché lo ione ossidrilico reagirà secondo la seguente reazione: OH- + CO2 (presente in acqua) >> HCO3- L’ aumento massiccio e subitaneo di HCO3- provocherebbe una rezione del sistema che spingerà verso un’ altra reazione, cercando di ristabilire l’ equilibrio nel seguente modo HCO3- + H2O <-> H3O+ + CO3- con formazione di ioni H3O+ per contrastare l’ aumento del pH e portando alla formazione di CO3- che, avendo una concentrazione maggiore libera, entra in supersaturazione (poiché come abbiamo visto in acqua marina solo una piccola parte dei carbonati è libera) e si legherebbe all’ elemento più disponibile in forma libera e cioè il calcio (poiché abbiamo visto che al contrario il magnesio si trova già perlopiù legato), formando un composto insolubile (CaCO3) e provocando una sua precipitazione, anche se il magnesio e lo stronzio e altri minerali saranno coinvolti nella precipitazione a causa del loro intimo legame con i carbonati, creando anche loro composti con i CO3 insolubili, poiché sia il magnesio che lo stronzio, che perlopiù sono legati ai bicarbonati (e non carbonati) formando composti solubili e non insolubili come quelli con i carbonati, precipitano anch’essi, a causa della porzione di bicarbonati a cui sono legati. 2HCO3- + Ca++ <-> CaCO3 + H2O +CO2 Ma poiché la concentrazione di magnesio è essenziale, come abbiamo visto prima, al mantenimento di un corretto equilibrio, la situazione ora sarà di avere meno calcio, meno magnesio e altri minerali, meno carbonati e alcalinità e tutto questo renderà l’ equilibrio ancora più precario per scongiurare altre precipitazioni. Quindi non solo aumentare il KH oltre un certo valore assieme ad una alta concentrazione di Ca può condurre a rischio precipitazione, ma anche aumentando una porzione di alcalinità (OH-) repentinamente, che indirettamente influenzerà la chimica dei carbonati. Quando quindi interverremo per aggiustare la concentrazione di calcio e carbonati dobbiamo stare attenti a tutte queste variabili e a farlo soprattutto lentamente. Se dobbiamo aumentare la concentrazione di calcio, dobbiamo considerare che la Kalkwasser e il reattore aumentano contemporaneamente anche l’ alcalinità del sistema portandoci ad una situazione in cui a causa delle piccole o più grandi precipitazioni ci ritroveremo in condizioni peggiori di quelle di partenza. Per aumentare il calcio tenete sotto controllo il KH e l’ alcalinità poiché se questi sono alti provocheremo solo fenomeni di precipitazioni. Possiamo in tal caso aggiungere lentissimamente solo cloruro di calcio (CaCl) in piccolissime dosi attendendo che i fenomeni di precipitazione biotica da parte dei coralli e alghe calcaree abbassino anche il KH (ma questo potrebbe voler dire attendere a lungo) o meglio sarebbe prima abbassare il KH (con uso oculatissimo di acidi deboli) e poi quando i valori del KH saranno intorno a 9 almeno, cominciare ad aumentare il calcio con CaCl. Aggiungere kalkwasser ad un sistema con calcio già un po’ alto e KH oltre 12 potrebbe portare solo ad una situazione di stallo. Ricordatevi che la Kalk e il reattore forniscono simultaneamente calcio e alcalinità e quindi entrambi aumenteranno. Balling e altre metodologieAbbiamo visto fin qui alcune metodologie “artificiali” per fornire il nostro acquario di calcio e alcalinità per il suo sviluppo e per la sua salute. L’ aggiunta di kalkwasser e il reattore di calcio sono fra le più usate e bisogna ammettere che i due sistemi associati porterebbero dei risultati ancora più soddisfacenti, poiché l’ utilizzo della kalkwasser contrasterebbe l’ abbassamento del pH causato dalla CO2 dei reattori di calcio (vi ricordate ormai le reazioni della CO2, vero?). Per il funzionamento e la regolazione dei reattori vi rimandiamo ai milioni di articoli che ci sono in rete. Fra le altre metologie che si possono usare per il reintegro del calcio quella che sembra l’ unica valida alternativa ad un reattore è il metodo Balling, un esperto tedesco che si è interessato da molto tempo a questo problema, in risposta all’ utilizzo della kalkwasser dove questa non possa essere sufficiente, o agli integratori commerciali venduti che, sebbene possano essere anche bilanciati, possono essere molto dispendiosi nel tempo. |

Continua a pagina: 1 2
Messaggio precedenteMarineland le meraviglie del mondo marino
Next PostL' acquario di Simone Toselli