Qualunque acquariofilo conosce l’importanza del pH e le sue implicazioni nel mantenimento dell’acquario. Ma per chi vuole dedicarsi al suo piccolo mondo acquatico in modo “scientifico” l’argomento necessita di approfondimento. Per gli animali e le piante che in essa vivono (e alcuni dei quali manteniamo in acquario) l’acqua non rappresenta soltanto l’elemento fisico nel quale muoversi e svolgere le propria esistenza, ma soprattutto il luogo in cui trova compimento l’insieme delle reazioni biochimiche e metaboliche necessarie a garantire la sopravvivenza di tali organismi. Grazie alla sua capacitā di disciogliere moltissime sostanze importanti da un punto di vista biologico, l’acqua costituisce, per i suoi abitanti, sia la fonte primaria da cui prelevare tali sostanze, sia il mezzo in cui vengono dispersi e “riciclati” i prodotti metabolici di rifiuto. In tal senso, definire l’acqua dei nostri acquari da un punto di vista esclusivamente chimico, come H2O, č limitativo: parlando di acqua intenderemo tutte le sostanze minerali e organiche che in essa sono disciolte e non soltanto il solvente inorganico (l’acqua, appunto) in cui si trovano in soluzione. Alla luce di tale definizione, ovviamente, l’acqua sarā ben diversa da vasca a vasca, cosė come, in natura, da fiume a fiume. Prescindendo dall’inquinamento provocato dall’uomo, le caratteristiche di un’acqua saranno determinate principalmente da tre fattori: – la provenienza geologica, cioč il tipo di terreno o di rocce che essa attraversa prima di giungere in superficie e in cui poi scorre. Tali rocce e terreni, a seconda della loro natura e composizione, cederanno all’acqua soprattutto sostanze minerali; – il tipo di movimento cui essa č sottoposta, che determinerā innanzitutto il tenore di ossigeno e anidride carbonica disciolti. Ad esempio, l’acqua di un ruscello sarā differente dall’acqua di un fiume a corso lento; – l’insieme di tutti i processi biologici che avvengono nel suo ambito. Per valutare l’acqua una scala da 1 a 14 Quest’ultimo fattore risulta spesso poco rilevante sulla qualitā dell’acqua quando, come negli oceani, nei fiumi e nei laghi, la sua massa sia infinitamente maggiore della massa biologica che essa ospita. Al contrario, nelle piccole pozze, nei bacini che non hanno un forte ricambio d’acqua, e nei nostri acquari, i processi biologici assumono un ruolo importante sulla qualitā del liquido.
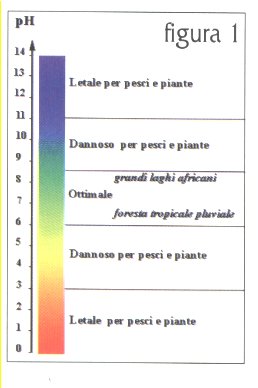
In un acquario, infatti, il volume d’acqua č limitato e il suo ricambio soltanto parziale e periodico. Inoltre, generalmente, si č piuttosto prossimi alla massa biologica critica, cioč al massimo di organismi che il sistema puō sostenere. La qualitā dell’acqua, quindi, nei nostri acquari potrā evolvere con il tempo, a causa delle caratteristiche intrinseche del sistema (dimensioni, grado di movimentazione dell’acqua, tipo e capacitā di filtrazione, ecc.) e soprattutto a causa del progressivo accumulo di sostanze di rifiuto. Dovremo perciō considerare sia le caratteristiche di un acqua all’origine, che indicano se essa č adatta all’uso in acquario (per l’allestimento della vasca e per i ricambi parziali), sia la loro evoluzione in funzione dei processi biochimici che avvengono nell’acquario stesso. Tra i parametri che definiscono le caratteristiche dell’acqua, tutti interconnessi tra di loro in modo pių o meno immediato, il pH č certamente quello che meglio puō dare un’immagine globale (seppure non completa) della qualitā del liquido considerato. Nell’acqua saranno presenti ioni idrogeno H+, la cui quantitā determinerā la sua aciditā o basicitā. Il pH esprime appunto la concentrazione di tali ioni, espressa in una scala che va da 0 a 14: un’acqua č acida per valori di pH inferiori a 7 (e tanto pių acida quanto minore č il valore del suo pH), mentre č basica per valori di pH superiori a 7 (e tanto pių basica quanto maggiore č il valore del suo pH). A pH 7 corrisponde infine un’acqua cosiddetta neutra. Acque molto acide (alte concentrazioni di ioni H+, bassi valori di pH) o molto basiche (basse concentrazioni di ioni H+, alti valori di pH) risultano particolarmente aggressive e quindi inadatte ad ospitare organismi viventi, cosė in acquario come in natura. Per la maggior parte dei pesci d’acqua dolce, il pH in acquario dovrā essere compreso tra 6,5 e 7,5. In genere i pesci provenienti dalle giungle amazzoniche e del Sud-Est asiatico preferiscono acque leggermente acide, mentre i Ciclidi dei grandi laghi africani acque leggermente basiche. La figura 1 mostra l’effetto del pH sugli organismi che comunemente manteniamo in acquario (i colori riportati a fianco dei valori di pH si riferiscono ai test colorimetrici per la determinazione dell’aciditā).
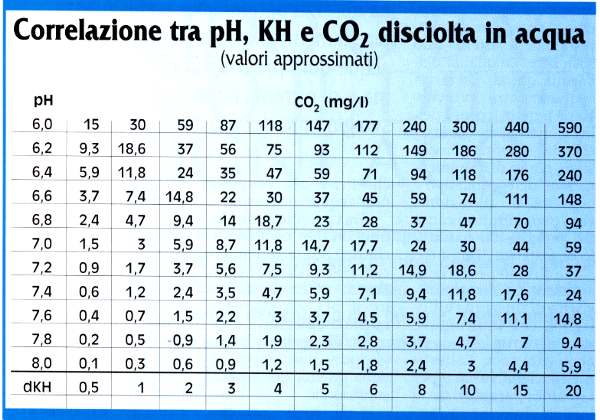
Ad ogni unitā di pH corrisponderā un fattore 10 sulla concentrazione di ioni H+, quindi passare da un pH 7 a un pH 5 significa aumentare di 100 volte l’aciditā della soluzione, analogamente un aumento di 1 unitā di pH (per esempio da pH 5,5 a pH 6,5) corrisponderā a una diminuzione di 10 volte. Dovremo quindi porre particolare attenzione al valore del pH e alle sue oscillazioni, in quanto una variazione di 0,3 unitā di pH (che potrebbe apparire insignificante) equivarrā a dimezzare o a raddoppiare la quantitā di ioni H+ in soluzione (e quindi l’aciditā dell’acqua). Ma cos’č che determina l’aciditā di un acqua? Quali composti chimici e quali processi biochimici sono responsabili del pH dell’acqua dei nostri acquari e della sua evoluzione nel tempo? pH, CO2, e durezza carbonatica Come abbiamo detto,l’acqua dolce conterrā sempre (tranne che nel caso dell’acqua distillata) una certa quantitā di costituenti minerali, derivanti principalmente dalla dissoluzione di sali inorganici. Tali sali saranno presenti in soluzione in forma dissociata, come ioni positivi e negativi: se per esempio sciogliamo in acqua del comune sale da cucina, il cui nome scientifico č cloruro di sodio e la cui formula NaCI, la dissoluzione del sale avverrā mediante la sua dissociazione, per cui in soluzione saranno presenti ioni Na+ e ioni Cl-, e non molecole indissociate NaCl. Nell’acqua saranno principalmente presenti ioni bicarbonato, solfato, nitrato e cloruro (ioni negativi) e ioni calcio, magnesio, sodio e potassio (ioni positivi), oltre ad una infinitā di altri ioni, in tracce. L’acqua puō quindi essere caratterizzata in base alla qualitā e quantitā dei principali ioni in essa contenuti, come avviene normalmente per le acque minerali, sulla cui etichetta č riportata la concentrazione delle sostanze minerali disciolte, espresse in ioni. Non č necessario conoscere l’esatta composizione dell’acqua che utilizziamo per i nostri acquari, ma č sufficiente conoscerne la durezza, che esprime la concentrazione in soluzione di alcuni ioni particolarmente importanti dal punto di vista dell’equilibrio biochimico. Per un’acqua saranno definite due durezze: la durezza temporanea (KH), chiamata anche durezza carbonatica, che si riferisce alla concentrazione di ioni carbonato C032- e ioni bicarbonato HC03-, e la durezza permanente (GH), relativa alla concentrazione degli altri ioni negativi, principalmente degli ioni solfato e cloruro. La durezza viene in genere misurata in gradi tedeschi dH, dove 1 grado corrisponde a 10 mg di ossido di calcio (CaO) per litro di soluzione (o, in alternativa, a 17,86 mg di carbonato di calcio per litro di soluzione). Sia per la durezza temporanea che per la durezza permanente viene utilizzata la medesima scala. Per ciascuna i gradi di durezza vengono indicati frapponendo al simbolo dH quello indicante il tipo di durezza in questione (per esempio con dGH si intenderā un grado di durezza permanente, mentre con dKH uno di durezza temporanea). La durezza permanente non influenza direttamente il pH (anche se in generale acque dure presentano un alto pH) ma č di estrema importanza per il normale svolgimento dei processi biologici. Quando si afferma che un certo pesce o pianta richiede un’acqua dolce o dura, ci si riferisce appunto alla durezza permanente. La durezza carbonatica sarā invece correlata al pH: acque con un KH basso saranno in genere acide, mentre acque con un KH elevato tenderanno verso la basicitā. Inoltre valori relativamente alti di durezza carbonatica determineranno una maggiore stabilitā del pH del sistema. A causa degli equilibri che si instaurano in acqua tra ioni carbonato, ioni bicarbonato, acido carbonico e anidride carbonica (vedi articolo “La durezza carbonatica”), ad una certa concentrazione di una specie corrisponderanno precise concentrazioni delle altre e relativi valori di pH. In pratica, quanto minore č la concentrazione di anidride carbonica e quanto maggiore č il KH (cioč la concentrazione di ioni carbonato e bicarbonato), tanto pių alto sarā il pH. La formula approssimata che correla tali tre grandezze e che, conoscendone due, permette di calcolare la terza č: (Nel box sotto č riportata la relativa tabella di correlazione).
Il valore della durezza temporanea e della durezza permanente definiscono quindi la qualitā dell’acqua da utilizzare quando si allestisce un acquario e pių adatta agli organismi che si vogliono ospitare. Il pH che misureremo, una volta riempita la vasca, dipenderā sostanzialmente dal KH dell’acqua e dalla concentrazione di anidride carbonica presente, determinata dall’aerazione della vasca e dal grado di movimentazione dell’acqua, che favoriscono il passaggio allo stato gassoso della CO2 disciolta nel liquido. L’evoluzione del pH in acquario In un acquario dotato di filtro biologico e contenente piante e pesci correttamente nutriti, la qualitā dell’acqua tenderā a cambiare, a causa dei processi metabolici e biochimici che avverranno al suo interno e all’accumulo delle relative sostanze di rifiuto. Oltre all’aumento progressivo della quantitā di sostanze inquinanti disciolte (in particolare degli ioni nitrato), si avrā anche un effetto sul pH e sulla durezza carbonatica, i cui valori varieranno. Normalmente il pH presenterā delle oscillazioni durante il corso della giornata e tenderā ad abbassarsi progressivamente nel tempo. Responsabile delle oscillazioni di pH nel corso delle 24 ore sarā la variazione di concentrazione di anidride carbonica: essa infatti viene prodotta dai pesci e dalle piante durante la respirazione e consumata dalle piante durante la fotosintesi. Durante il giorno, a seguito della fotosintesi, la concentrazione di anidride carbonica tenderā ad abbassarsi e il pH, di conseguenza, ad aumentare. Al contrario, durante le ore notturne, anche le piante, come i pesci, produrranno anidride carbonica, la cui concentrazione quindi aumenterā, causando un abbassamento del pH. In genere il valore minimo di pH viene raggiunto al mattino e il valore massimo alla sera, rispettivamente prima dell’accensione e dello spegnimento del sistema di illumuiazione. Tale escursione di pH nel corso delle 24 ore puō assumere proporzioni drammatiche in acquari troppo ricchi di vegetazione (o di alghe infestanti) e soprattutto quando il KH non sia sufficientemente elevato da esercitare la sua funzione tampone sul sistema. Come si puō infatti notare dalla giā citata tabella di correlazione, l’effetto di una variazione di concentrazione di anidride carbonica sul pH sarā tanto pių importante quanto pių la durezza carbonatica č bassa. Un innalzamento del pH durante il corso della giornata e un concomitante abbassamento progressivo della durezza carbonatica saranno per-tanto segnali inequivocabili di una carenza di CO2 nel nostro acquario. Per quanto riguarda invece il progressivo abbassamento del pH nel tempo, esso sarā causato principalmente dai processi di decomposizione del materiale organico di rifiuto da parte dei batteri, presenti principalmente nel filtro biologico. Il processo complessivo che dal materiale organico azotato porta ai nitrati viene detto mineralizzazione. Oltre che alla formazione di ioni nitrato, il processo di mineralizzazione porta alla formazione di anidride carbonica e di ioni H+. Avremo quindi un abbassamento del pH, particolarmente evidente negli acquari molto popolati. Anche in tal caso l’effetto sarā minimizzato dalla funzione tampone esercitata dalla durezza carbonatica: il pH resterā stabile o tenderā ad abbassarsi molto lentamente e sarā il valore del KH a diminuire. In seguito al risultante abbassamento della durezza temporanea potranno poi aversi variazioni anche importanti e brusche di pH, avendo l’acqua perso il suo principale tampone naturale. Il pH č certamente il pių importante fattore di controllo in un acquario, essendo il suo valore strettamente correlato alla concentrazione di anidride carbonica e alla durezza carbonatica dell’acqua, nonché agli equilibri biochimici che intervengono nella trasformazione dei rifiuti organici in nitrati. Per tutti gli organismi che ospitiamo in acquario sarā vitale non soltanto un corretto valore di pH, ma anche la sua stabilitā, l’assenza cioč di brusche variazioni in brevi intervalli di tempo. Sia il valore del pH che la sua stabilitā nel tempo potranno essere assicurati agendo sul KH o sulla concentrazione di anidride carbonica (o su entrambi). In un’acqua priva di un’adeguata durezza carbonatica l’escursione diurna della aciditā potrā sommarsi con l’aumento di acidita a lungo termine, causato dalla naturale decomposizione del materiale organico di rifiuto, provocando un brusco abbassamento del pH, con effetti catastrofici sull’intero sistema. Bisognerā, pertanto, mantenere la durezza carbonatica a valori relativamente elevati, ad esempio mediante ricambi d’acqua, oppure provvedere all’apporto di CO2 mantenendone costante la concentrazione nell’arco delle 24 ore, assicurando così la stabilitā del pH e della durezza temporanea (oltre a esercitare una funzione positiva sulla crescita delle piante). Tipici valori di pH, KH e concentrazione di CO2, per un acquario di comunitā con abbondante vegetazione saranno: – pH circa 6,9 Sarā importante quindi eseguire regolarmente la misurazione non soltanto dell’aciditā dell’acqua, ma anche della sua durezza carbonatica e della concentrazione di anidride carbonica. La concentrazione di anidride carbonica in acqua non č semplice da misurare e molti dei test in commercio ne forniscono soltanto una indicazione qualitativa. Conoscendo comunque i valori di pH e KH dell’acqua, essa puō essere facilmente calcolata, anche se in modo approssimato, usando l’equazione riportata o utilizzando la tabella di correlazione. Questo articolo č stato pubblicato sul numero 22 – Luglio 2000 – della rivista ‘il mio acquario’ la quale ha concesso tale ripubblicazione |
Messaggio precedenteUn lago in casa vostra - Informazioni sui ciclidi del lago Malawi
Next PostZeovit - Considerazioni dopo due mesi di utilizzo